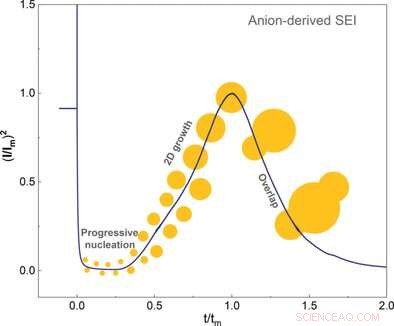
© Wiley-VCH. Crédit :Angewandte Chemie International Edition doi.org/10.1002/anie.202100494
Les batteries se chargent et se rechargent, apparemment grâce à une interaction parfaite entre le matériau de l'électrode et l'électrolyte. Cependant, pour une fonction de batterie idéale, l'interphase d'électrolyte solide (SEI) joue un rôle crucial. Les scientifiques des matériaux ont maintenant étudié la nucléation et la croissance de cette couche en détail atomique. Selon l'étude publiée dans la revue Angewandte Chemie , les propriétés des anions et des molécules de solvant doivent être bien équilibrées.
Dans les batteries lithium-ion, les formulaires SEI au début du premier processus de charge, lorsqu'un potentiel est appliqué. Les éléments de l'électrolyte se déposent sur l'électrode en graphite et forment un revêtement qui recouvre rapidement toute l'électrode. Ce n'est qu'une fois cette couche terminée que les ions lithium positifs peuvent-ils s'intercaler dans l'électrode sans exfolier le matériau de l'électrode.
Qiang Zhang et ses collègues de l'Université Tsinghua, Pékin, Chine, ont maintenant examiné de plus près la nucléation et la croissance du SEI. L'électrolyte des batteries lithium-ion contient du sel de lithium et un solvant. Des solvants fortement solvatants enveloppent l'ion lithium, et les anions flottent librement. En revanche, des électrolytes faiblement solvatants permettent une fixation plus étroite des anions sur l'ion lithium. Ici, les anions restent une partie de l'enveloppe de solvatation interne.
Cette enveloppe de solvatation interne doit être retirée du lithium pour permettre la formation et la croissance de SEI. Les chercheurs ont démontré que les anions de la coque interne s'adsorbaient d'abord au niveau de l'électrode fraîche, puis absorbaient deux électrons lors d'une réaction électrochimique. Ce dernier événement a déclenché la décomposition et la nucléation du SEI. Les auteurs ont conclu que la formation de SEI dépendait principalement de la facilité avec laquelle les anions peuvent saisir les électrons et se décomposer par rapport au solvant.
Les scientifiques ont utilisé des techniques électrochimiques et la microscopie à force atomique pour étudier la croissance cristalline jusqu'à l'achèvement de la couche. Ils ont découvert qu'une couche lisse ne se formait qu'à de faibles surtensions. Le solvant a également influencé la surtension. Les auteurs ont également noté que les solvants ayant une affinité élevée pour la couche cristalline ne produisaient aucune surtension du tout.
Ils ont conclu que les futures conceptions d'électrodes hautes performances devraient se concentrer davantage sur l'interaction entre les ions négatifs du sel de lithium et le solvant. Pour permettre un inorganique homogène, SEI cristallin à former, les anions devraient supplanter le solvant; ils devraient s'adsorber plus facilement à la surface de l'électrode et entreprendre des réactions électrochimiques. En outre, les produits de décomposition doivent être solides et insolubles, mais montrent encore une certaine affinité pour le solvant, disaient les auteurs.