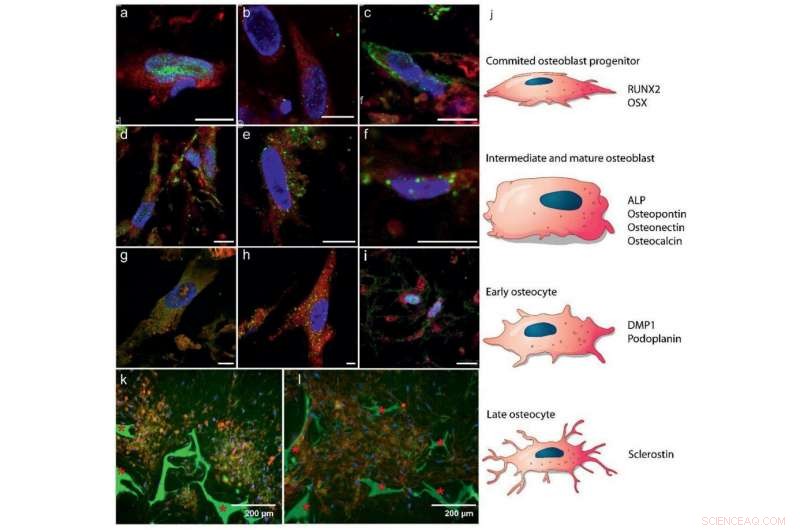
Différenciation des hBMSCs en ostéoblastes et ostéocytes :a–i) Imagerie par immunohistochimie de fluorescence montrant des marqueurs pour a–c) les premiers stades de la formation des ostéoblastes, d–f) ostéoblastes matures, et g–i) développement des ostéocytes (5,55 mm de glucose). Code couleur :rouge – cytoplasme cellulaire, bleu – noyaux cellulaires, vert :a) RUNX2 (jour 7), b) OSX (jour 7), c) ALP (jour 26), d) ostéocalcine (jour 26), e) ostéopontine (jour 26), f) ostéonectine (jour 21), g) DMP1 (jour 28), h) podoplanine (jour 28), et i) la sclérostine (jour 28). Barres d'échelle :10 µm. Voir la figure S4, Renseignements à l'appui, pour des canaux séparés. j) Illustration schématique de la différenciation des CSM en ostéoblastes et ostéocytes, indiquant à quel état quelle expression de protéine est attendue dans a–i. k, l) Images fluorescentes indiquant des domaines auto‐organisés d'ostéocytes noyés dans une matrice minéralisée après 8 semaines (glucose 25 mm), k) co‐localisation des ostéocytes (sclérostine, rouge) et minérale (calcéine, vert), et l) collagène (CNA35, rouge) et minérale (calcéine, vert) * Indique l'échafaudage de fibroïne de soie.
Imaginez utiliser des cellules souches de votre moelle osseuse pour faire pousser un morceau de tissu osseux en laboratoire, après quoi les médecins explorent les médicaments qui ont l'effet souhaité sur vos os. De cette façon, un plan de traitement sur mesure serait élaboré pour chacun, la meilleure approche étant claire à l'avance :la médecine personnalisée à son meilleur.
Cette vision de l'avenir n'est plus de la science-fiction maintenant que les chercheurs de l'Université de technologie d'Eindhoven et du centre médical universitaire de Radboud ont en fait réalisé la première partie :faire pousser un morceau de tissu osseux réaliste à partir de cellules souches humaines. C'est le premier organoïde de l'os, une version simplifiée de l'original, les chercheurs rapportent aujourd'hui dans le journal Matériaux fonctionnels avancés .
Image cohérente
"Avec ça, nous présentons, pour la première fois, l'image complète de la formation osseuse à un stade précoce, " dit Sandra Hofmann, professeur agrégé en Bioingénierie Os de TU/e. Et c'est d'une grande importance :la façon dont nos os se forment est encore largement un mystère. L'os est un matériau très complexe dans lequel interagissent d'innombrables cellules et processus, et comprend une matrice ingénieuse de collagène et de minéraux pour fournir de la force. On en sait beaucoup sur les composants individuels, mais une image cohérente a fait défaut jusqu'à présent.
Trois types de cellules jouent le rôle principal dans la formation osseuse :les ostéoblastes (qui construisent le tissu osseux), les ostéoclastes (qui enlèvent les os) et les ostéocytes (qui régulent la construction et la dégradation des os). « Jusqu'à présent, la plupart des études se sont concentrées sur l'un de ces types de cellules, mais ce n'est pas une bonne représentation du vrai tissu, " dit Hofmann. " Nous présentons ici un morceau d'os tissé (os à un stade précoce) qui s'est développé à partir de cellules souches et contient deux types de ces cellules :les ostéoblastes et les ostéocytes. Nous voyons maintenant que nous pouvons fabriquer des os réalistes exclusivement avec ces deux types de cellules. »
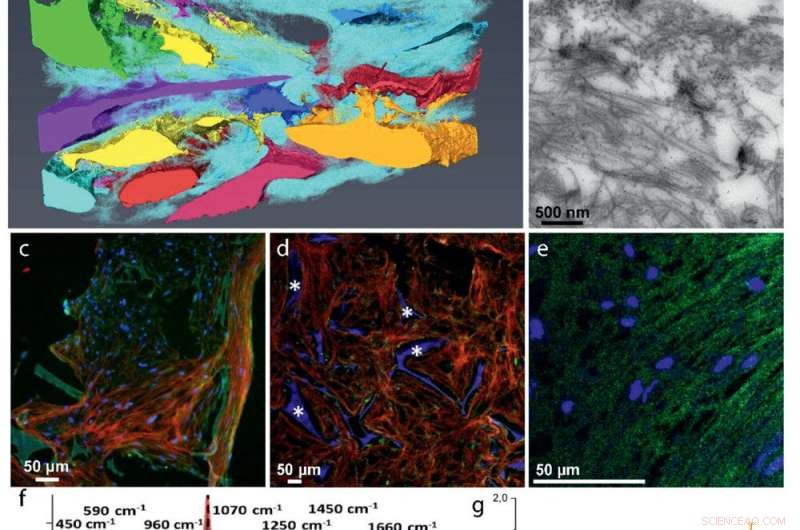
Développement ECM :a) La reconstruction 3D FIB/SEM montre l'inclusion des cellules dans la matrice de collagène (cyan). Les cellules discrètes sont représentées avec des couleurs différentes. b) Image MET d'une section de 70 nm montrant la distribution aléatoire des fibrilles de collagène. Le collagène de type I a été identifié par immunomarquage. c–e) Immunohistochimie fluorescente identifiant des protéines non‐collagènes clés dans la matrice collagène :c) Co‐localisation de l'ostéocalcine (vert) et du collagène (rouge). d) Distribution de l'ostéopontine (vert) dans la matrice de collagène (rouge). * Indique l'échafaudage de fibroïne de soie. e) Co‐localisation de DMP1 (vert) avec la structure du collagène (voir Figure S5, Renseignements à l'appui, pour l'image de collagène). f–g) Microspectrométrie Raman de matrices minéralisées. f) Spectres Raman localisés de collagène minéralisé d'os de poisson zèbre en développement (rouge), la co‐culture ostéogénique 3D (bleu), et os humain d'une femelle de 10 ans (gris g) Rapports minéraux/matrice dérivés de Raman de 4 tissus minéralisés de poisson zèbre (N =6, rouge), Culture 3D ostéogénique (N = 7, vert), Femelle humaine de 10 ans (N = 1, gris), et 48 ans et plus de sexe masculin (N = 7, le noir, extrait de la réf. [36]). Les barres indiquent les écarts types des échantillons. h) Présentation par carte thermique d'une coupe transversale 3D FIB/SEM montrant des fibrilles de collagène désorganisées avec différents degrés de minéralisation (Figure S10, Renseignements à l'appui). Les pointes de flèches indiquent les fibrilles de collagène non minéralisées (bleu clair), la flèche indique la fibrille de collagène minéralisée (orange). i) Image MET montrant des fibrilles de collagène minéralisées individuelles.
Devenir plus sage grâce au piquetage moléculaire
"Et peut-être plus important encore, notre système se comporte comme un os à un stade précoce, " dit Anat Akiva, professeur assistant de biologie cellulaire à Radboudumc. "Nous montrons que les deux types de cellules produisent les protéines dont elles ont besoin pour leur fonctionnalité, et nous montrons avec le plus grand détail que la matrice est en fait la matrice osseuse que nous voyons dans le vrai tissu. »
Le fait qu'une représentation simplifiée de la formation de l'os au niveau moléculaire soit désormais possible offre des possibilités inédites, selon les chercheurs. "Un os est composé à 99% de collagène et de minéraux, mais il y a aussi un autre 1% de protéines qui sont essentielles pour une formation osseuse réussie, " explique le professeur Nico Sommerdijk de Radboudumc. " Alors quel est le rôle de ces protéines ? Comment soutiennent-ils la formation osseuse? Jamais auparavant nous n'avions été en mesure d'examiner les jalons de ce processus au niveau moléculaire."
Et avec cela, ils ont immédiatement une bonne entrée pour enquêter sur la cause des maladies osseuses génétiques telles que la "maladie des os fragiles" et leurs traitements possibles. "Rappelez-vous que l'origine de nombreuses maladies se situe au niveau moléculaire, de même que le traitement, " dit Akiva. " En fait, nous avons maintenant un système simple dans un environnement fiable dans lequel nous pouvons fouiller et voir comment les cellules osseuses réagissent aux stimuli que nous fournissons."