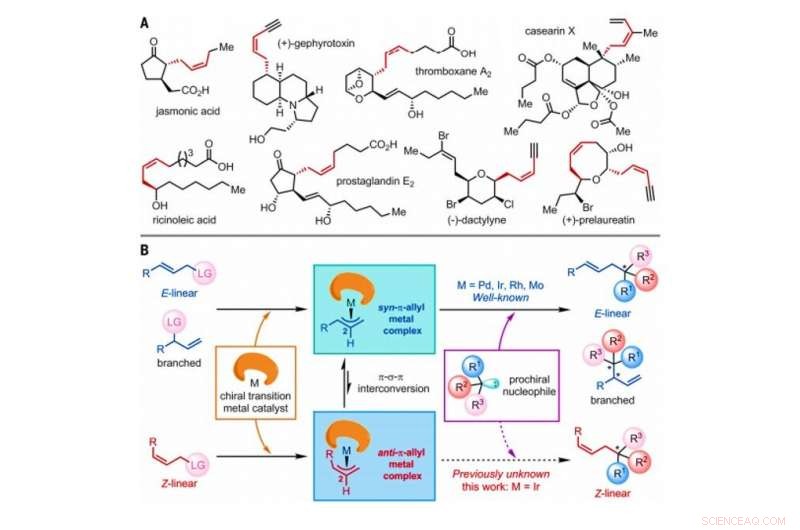
Stratégie pour la construction de Z-oléfines via des réactions de substitution allylique asymétriques catalysées par des catalyseurs de métaux de transition. (A) Produits naturels sélectionnés contenant des Z-oléfines avec des stéréocentres homoallyliques. Moi, méthyle. (B) Mécanisme général proposé des réactions de substitution allylique asymétrique catalysées par un métal de transition impliquant E-linéaire, ramifié, ou des substrats oléfiniques linéaires Z, qui comprennent tous un atome ou un groupe d'atomes désigné comme un groupe partant (LG). Crédit :Sciences, doi:10.1126/science.abd6095
En chimie organique de synthèse, Les Z-oléfines sont une cible synthétique difficile à produire en laboratoire en raison de leur instabilité thermodynamique relative. Les Z-oléfines forment un composé insaturé avec un C
Oléfines
L'isomère géométrique de type Z des oléfines est largement observé en tant que structures de base dans la nature. Néanmoins, Les Z-oléfines sont comparativement moins stables par rapport à leurs homologues de type E, et donc, il est difficile de les synthétiser sélectivement en chimie organique. Les méthodes courantes pour accéder aux Z-oléfines comprennent l'isomérisation photo-induite des E-oléfines, Soit l'oléfination, Métathèse croisée sélective Z, Couplage croisé à rétention de Z et addition asymétrique de nucléophiles de Z-allylbore aux cétones et aux imines. Les Z-oléfines avec un stéréocentre homoallylique sont souvent incorporées dans divers produits naturels et molécules bioactives pour générer un intérêt considérable pour la chimie organique de synthèse. Les chercheurs ont montré la capacité de conduire des réactions de substitution allylique asymétriques catalysées par des métaux de transition dont le molybdène (Mo), palladium (Pd), l'iridium (Ir) et le rhodium (Rh). Depuis son premier rapport en 1997, Les réactions de substitution allylique asymétrique catalysées par l'Ir ont suscité une attention intense en raison de leur nature régio- et énantiosélective exceptionnellement élevée. Dans ce travail, Jiang et al. ont rapporté des réactions de substrats allyliques linéaires Z avec des tryptamines et du tryptophol. Au cours de l'analyse complète des mécanismes réactionnels, ils ont noté la formation de complexes anti-π-allyl-iridium clés, avant isomérisation pour former les contreparties syn-π-allyl-iridium thermodynamiquement stables.
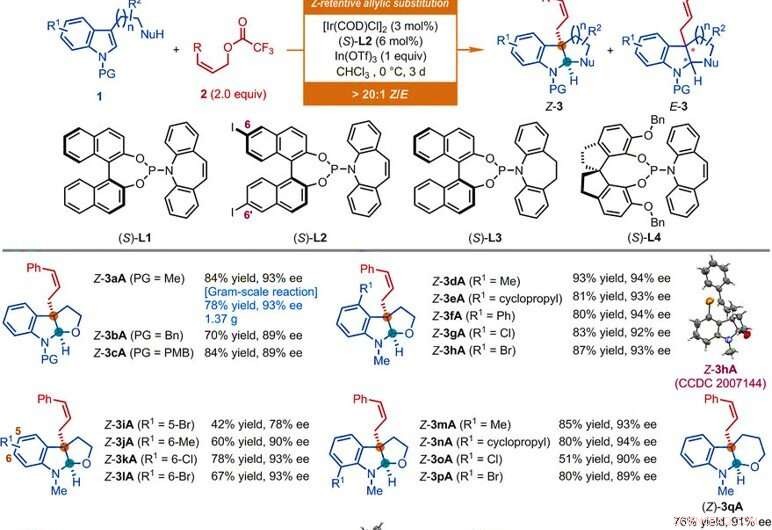
Champ d'application du substrat des réactions de substitution allylique asymétriques catalysées par l'Ir de dérivés d'indole. Toutes les réactions ont été conduites selon les conditions données ici, Sauf indication contraire. Le rapport géométrique du type Z au type E (Z/E) et le rapport diastéréoisomérique (dr) ont été déterminés par analyse RMN 1H des mélanges bruts. Les rendements isolés de Z-3 sont rapportés. Les valeurs ee ont été déterminées par analyse par chromatographie liquide à haute performance (HPLC) avec une phase stationnaire chirale. L'astérisque indique un rapport Z/E de 7:1. Le symbole à un poignard indique un rapport Z/E de 8:1. Le symbole de la double dague indique que les réactions ont été menées pendant 1 jour. Le symbole de section indique un rapport Z/E de 11:1. Le symbole de paragraphe indique que les réactions ont été conduites en utilisant de l'acétate de (Z)-non-2-én-1-yle, [Ir(DCO)Cl]2 (3 % mol), (S)-L1 (6 mol %), InBr3 (1.0 équiv), et bromure de tétrabutylammonium (0,5 équiv) dans CHCl3 à 0°C. Le symbole dièse indique que les réactions ont été conduites en utilisant les acétates allyliques Z correspondants, [Ir(DCO)Cl]2 (4,5 mol %), (S)-L2 (9 mol %), In(OTf)3 (0,5 équiv pour Z-3aS et Z-3aT; 1 équiv pour Z-3aU) dans CHCl3 à -10°C pendant 2 jours. Bn, benzyle; Bu, butyle; Et, éthyle; Mme, mésyle; Ph, phényle; PMB, para-méthoxybenzyle; p-Tol, para-tolyle; Ts, tosyle. Crédit :Sciences, doi:10.1126/science.abd6095
Les chercheurs ont d'abord étudié la réaction de désaromatisation allylique asymétrique impliquant des nucléophiles tels que le N-méthyl tryptophol avec des dérivés de Z-cinnamyle. En utilisant l'acétate de Z-cinnamyle, ils ont obtenu la réaction souhaitée avec un catalyseur dérivé du dimère de chlore d'iridium cyclooctadiène (COD) en présence d'autres composés synthétiques. Les scientifiques ont obtenu le produit cible avec un rendement et une énantiosélectivité modérés avec un rapport géométrique de type Z à type E de 2:1. Ils ont ensuite optimisé les constituants pour améliorer la qualité et le rendement des produits synthétiques. Sur la base de la réaction de substitution allylique asymétrique à rétention Z proposée, Jiang et al. obtenu une compatibilité de divers groupes fonctionnels qui tolérait une large gamme de substrats. L'équipe a synthétisé avec succès plus de 50 exemples d'(homo)tryptophols, substrats de tryptamines et d'indole portant un nucléophile à base de carbone pendant en utilisant des dérivés de Z-cinnamyle. Presque toutes les réactions ont fourni un rendement de rapports de type Z sur type E supérieurs à 20:1. Les exemples incluent les furoindolines Z-cinnamylées correspondantes (en abrégé Z-3aA en Z-3pA), tétrahydropyranindoline (en abrégé Z-3qA), les pyrroloindolines (en abrégé Z-3a'A en Z-3o'A) et les hexahydrocyclopentaindoles (en abrégé Z-3a′′A en Z-3c′′A) avec de bons rendements allant jusqu'à 94 pour cent. Généralement, la substitution de diverses propriétés électroniques et stériques aux positions disponibles du cycle indole n'a eu aucun impact délétère sur l'efficacité ou l'énantiosélectivité de la réaction. Les chercheurs ont établi les structures et la configuration absolue des produits à l'aide d'une analyse cristallographique aux rayons X. Ils ont ensuite également examiné les performances des dérivés du D- et L-tryptophane.
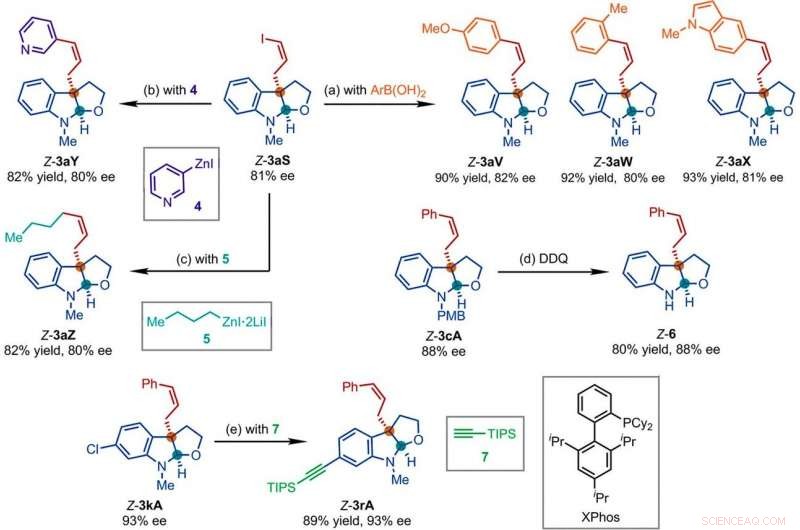
Produits représentatifs obtenus dans des réactions ultérieures avec les produits de la réaction de substitution allylique asymétrique à rétention Z catalysée par Ir. Conditions de réaction :(a) Pd(PPh3)4 (0,5 mol %), Cs2CO3 (2 équiv), ArB(OH)2 (1,5 équiv), acétonitrile, 50°C; (b) 4 (2 équiv), THF/diglyme (1:1), 110°C, 24 heures; (c) 5 (2 équiv), LiCl (4 équiv), toluène/THF/TMU, 110°C, 24 heures; (d) DDQ (1,5 équiv), CH2Cl2, NaH2PO4 (aqueux 1 M); (e) 7 (2 équiv), PdCl2(CH3CN)2 (5 % en moles), XPhos (15 mol %), Cs2CO3 (2,5 équiv), acétonitrile, 80°C. Ar, aryle; THF, tétrahydrofurane; DES ASTUCES, triisopropylsilyle; TMU, 1, 1, 3, 3-tétraméthylurée. Crédit :Sciences, doi:10.1126/science.abd6095
Transformations en aval
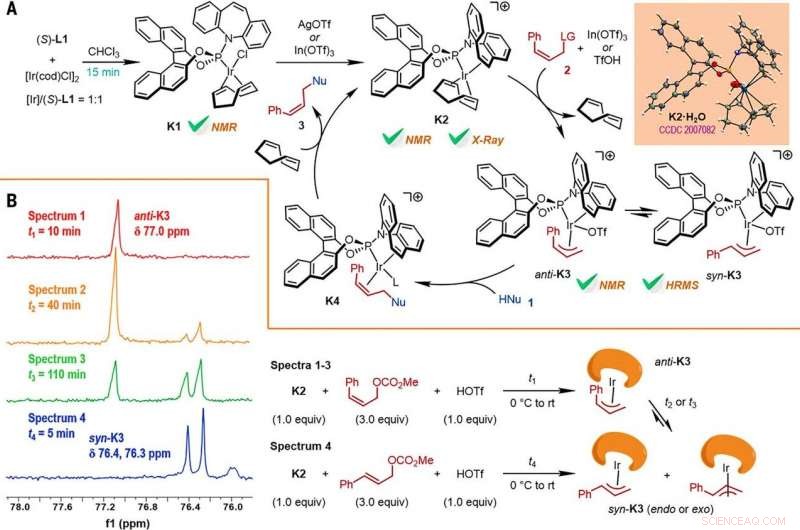
Les chercheurs ont ensuite étudié comment un certain nombre de produits de la réaction de substitution allylique asymétrique à rétention Z pouvaient être facilement étudiés dans diverses transformations en aval. Par exemple, le Z-vinyl iodure des furoindolines chirales (en abrégé Z-3aS) était réactif vis-à-vis des acides aryl boroniques et des réactifs organozinciques. Cela a fourni une voie alternative pour produire des produits représentatifs catalysés par l'Ir, Réactions de substitution allylique asymétrique à rétention Z avec des rendements élevés allant jusqu'à 82 à 93%. The scientists evaluated the proposed Z-retentive asymmetric allylic substitution reactions by a series of analyses. They obtained the Z-cinnamylated furoindolines (Z-3aA) product with optimal results in the presence of iridium atoms in the catalyst in a molar ratio of 1:1. They then characterized the key intermediates in the catalytic cycle and elucidated their structures using nuclear magnetic resonance (NMR) spectroscopy alongside X-ray crystallographic analysis. The team also monitored the reactions using electrospray ionization mass spectrometry and mechanistic studies. These results showed the isomerization of the complex from an anti- to the syn-π-allyl-iridium complex. Collectively, the analyses showed how the proposed Z-retentive asymmetric allylic substitution reaction successfully originated from the rapid and enantioselective capture of the transient anti-π-allyl-iridium complex by external nucleophiles, before converting it to more thermodynamically stable species.
Reaction mechanism studies. (A) A proposed catalytic cycle. The key intermediates K1 and K2 were characterized by NMR spectroscopy, while K2•H2O was characterized by x-ray crystallographic analysis. HRMS, high-resolution mass spectrometry. (B) The reactions of K2 with Z- or E-cinnamyl methyl carbonate demonstrated isomerization from anti-K3 to syn-K3 according to the results of monitoring by electrospray ionization mass spectrometry (ESI-MS) and 31P NMR spectroscopy, the results of which are shown at left, with the details given by the reaction process diagrams to the right. Credit:Science, doi:10.1126/science.abd6095
Exploring the synthetic spectrum
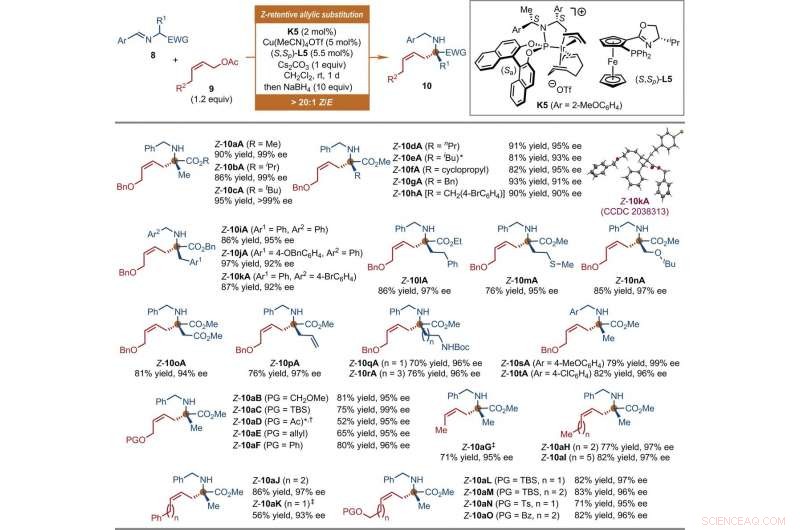
The scientists also explored the extension of this iridium-catalyzed Z-retentive asymmetric allylic substitution reaction to other nucleophiles. Aside from the iridium catalysts containing Carreira-type chiral ligands that function under acidic conditions, they explored Ir catalysts derived from a Feringa-type chiral phosphoramidite ligand applied under basic conditions for this reaction mode. Par conséquent, Jiang et al. used diverse nucleophiles beyond tryptophols and tryptamines. Dans ce cas, they formed the prochiral nucleophiles from a copper (Cu) source. The independently prepared chiral cyclometallated Ir complex promoted the development of the transient anti-π-allyl-iridium complexes as well as their regio- and enantio-selective captures. The broad scope of the reaction presented more than 30 synthetic samples in good yields with excellent enantioselectivity. The scientists investigated the structure and absolute configuration of the products using X-ray crystallographic analyses. When the team used Z-cinnamyl acetate, they obtained a mixture of the desired Z-cinnamylated product and its branched isomer. The results highlighted the possibility of using the proposed protocol to accommodate diverse prochiral nucleophiles in asymmetric allylic substitution reactions. The researchers expect the work to evolve into a broadly practical method to synthesize chiral Z-olefins in the lab.
Substrate scope of Ir-catalyzed Z-retentive asymmetric allylic substitution reactions of a-amino acid derivatives. All reactions were conducted under the following conditions. Step 1:8 (0.2 mmol, 1 equiv), 9 (1.2 equiv), K5 (2 mol %), Cu(MeCN)4OTf (5 mol %), (S, Sp)-L5 (5.5 mol %), and Cs2CO3 (1 equiv) in CH2Cl2 (2 ml) at room temperature. Step 2:Reaction residue of step 1, NaBH4 (10 equiv) in CH2Cl2/MeOH (1:1, 4 ml) at room temperature. The Z-type to E-type geometric ratio (Z/E) values were determined by 1 H NMR analysis of the crude mixtures of step 1. The isolated yields of linear Z-10 are reported. The ee values were determined by HPLC analysis with a chiral stationary phase. The asterisk indicates that 9 (1.5 equiv) and K5 (4 mol %) were used. The single-dagger symbol indicates a Z/E ratio of 5.3:1. The double-dagger symbol indicates that 9 (2 equiv) was used. Ac, acetyl; Boc, tert-butoxycarbonyl; Bz, benzoyl; EWG, electron-withdrawing group; PG, protecting group; Pr, propyl; SCT, tert-butyldimethylsilyl. Credit:Science, doi:10.1126/science.abd6095
© 2021 Réseau Science X