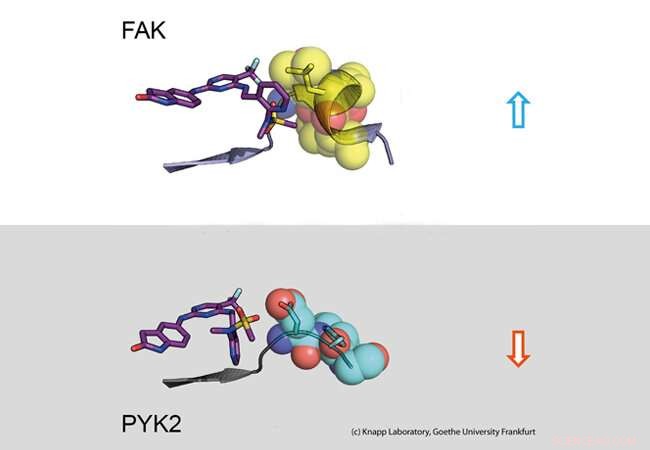
Partie supérieure :Temps de séjour long. Un inhibiteur (à gauche :modèle de bâton) se lie à la molécule signal FAK (à droite :une partie de la protéine FAK représentée comme modèle de calotte avec des sphères). Le changement structurel de FAK provoque des contacts hydrophobes (jaune, soi-disant motif DFG) et un engagement de longue durée. Partie inférieure :Temps de séjour court. La protéine signal PYK2 ne change pas sa structure lors de la liaison de l'inhibiteur, entraînant ainsi une dissociation rapide de l'inhibiteur. Crédit :Laboratoire Knapp, Université Goethe de Francfort
De nombreux médicaments anticancéreux bloquent les signaux dans les cellules cancéreuses qui aident les cellules dégénérées à se multiplier de manière incontrôlable et à se détacher des tissus. Par exemple, bloquer la protéine de signalisation FAK, une soi-disant kinase, rend les cellules cancéreuses du sein moins mobiles et donc moins susceptibles de métastaser. Le problème est que lorsque FAK est bloqué par un inhibiteur, la protéine de signalisation étroitement liée PYK2 devient beaucoup plus active et prend ainsi en charge certaines des tâches de FAK. L'idéal serait donc un inhibiteur qui inhibe à la fois FAK et PYK2 de la même manière le plus longtemps possible.
Une équipe internationale dirigée par le chimiste pharmaceutique Prof. Stefan Knapp de l'Université Goethe a étudié une série d'inhibiteurs de FAK spécialement synthétisés. Tous les inhibiteurs se sont liés à la protéine FAK à peu près au même taux. Cependant, ils différaient par la durée de liaison :l'inhibiteur le plus efficace restait lié à la protéine de signalisation FAK le plus longtemps.
En utilisant des analyses de biologie structurale et moléculaire ainsi que des simulations informatiques, l'équipe de recherche a découvert que la liaison d'inhibiteurs qui restent longtemps dans la poche de liaison FAK induit un changement structurel. Ainsi, par la liaison de ces inhibiteurs, FAK change de forme et forme un structure hydrofuge aux points de contact avec l'inhibiteur, comparable à une étreinte intime.
La protéine étroitement apparentée PYK2, d'autre part, est resté relativement rigide, et bien que l'inhibiteur de FAK le plus efficace bloque également PYK2, son effet était significativement plus faible en raison de la dissociation rapide des inhibiteurs du site de liaison. De façon intéressante, les simulations informatiques ont pu très bien prédire la cinétique de liaison, la fourniture d'un procédé de simulation précise des taux de dissociation de médicaments pour une optimisation future de candidats médicaments.
Le professeur Stefan Knapp explique, "Parce que nous avons maintenant une meilleure compréhension des mécanismes moléculaires de l'interaction d'inhibiteurs puissants de ces deux kinases, nous espérons pouvoir utiliser des simulations informatiques pour mieux prédire les temps de résidence des inhibiteurs et des médicaments candidats à l'avenir. Jusque là, peu d'attention a été accordée aux propriétés cinétiques de la liaison aux médicaments. Cependant, cette propriété est maintenant apparue comme un paramètre important pour le développement de médicaments plus efficaces qui sont conçus pour inhiber leurs protéines cibles - comme dans le cas de FAK et PYK2 - non seulement puissamment mais aussi pendant longtemps."