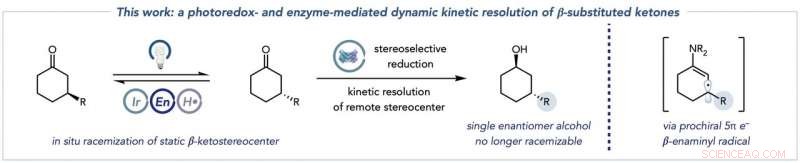
La transformation globale combinant la racémisation des substrats cétoniques (à gauche) avec la réduction biocatalytique en produits alcooliques énantiomériquement purs (au centre), et l'espèce de radical énaminyle clé que cette chimie déverrouille pour permettre la racémisation de -cétostéréocentres typiquement statiques (à droite). Crédit :Jacob DeHovitz
Une collaboration entre deux laboratoires du département de chimie de l'université de Princeton a abouti à une nouvelle plate-forme saisissante qui permet aux chimistes de réinterpréter les règles de la stéréochimie et du stéréocontrôle avec des implications importantes pour les industries pharmaceutiques et agrochimiques.
La recherche démontre la capacité de la catalyse photorédox à prendre des stéréocentres traditionnellement statiques et à les rendre dynamiques en rompant et en reformant de manière continue et contrôlable les liaisons moléculaires. Il est prometteur pour les scientifiques de définir les stéréocentres d'un composé cible complexe de manière succincte, étape efficace plutôt qu'un stéréocentre à la fois. (Un stéréocentre donne une asymétrie d'image miroir à une molécule, ce qui est important pour déterminer les propriétés biologiquement actives au cours de la synthèse.)
La collaboration associe l'expertise du laboratoire MacMillan et du laboratoire Hyster. Le papier, "Stéréocontrôle statique à dynamique inductible :l'utilisation convergente des cétones racémiques -substituées, " apparaît dans Science cette semaine.
"Normalement, quand vous pensez à construire des molécules contenant des stéréocentres, vous pensez à mettre le stéréocentre dans l'événement de formation de lien, " a déclaré Todd Hyster, professeur adjoint de chimie. "Et ce que nous avons découvert, c'est que si vous utilisez la catalyse photoredox, vous pouvez essentiellement déverrouiller des mécanismes pour créer des stéréocentres qui seraient autrement statiques, ou fixe. Vous pouvez les rendre dynamiques.
« Lorsque vous les associez à des enzymes hautement sélectives, vous pouvez penser à construire des molécules stéréochimiquement complexes d'une toute nouvelle manière."
La stéréochimie implique la disposition spatiale des atomes et la façon dont ils peuvent être manipulés dans la structure moléculaire pour obtenir les résultats souhaités. Cela vient du fait que le carbone a quatre substituants. Ces quatre substituants sont différents; ils doivent exister comme des images miroir l'un de l'autre. Ces images miroir sont appelées énantiomères. Nos mains sont des énantiomères, par exemple; ce sont des images miroir l'une de l'autre. Ce que cela signifie pratiquement, c'est qu'ils ne peuvent pas être superposés - un gant gauche ne s'adaptera pas à une main droite.
Le corps humain réagit aux médicaments exactement de la même manière. Notre matière biologique est constituée d'une série d'images miroir et non de l'autre. Le corps peut reconnaître la différence entre deux médicaments qui semblent identiques même si l'un est une image miroir et l'autre ne l'est pas. Cette reconnaissance influence l'adoption et donc l'efficacité des thérapies.
Ce que les recherches de MacMillan et Hyster ont découvert, c'est un moyen de découpler la configuration du stéréocentre de l'étape dans laquelle il se forme, ou racémisé. Être capable de contrôler cette racémisation est important pour le développement des médicaments les plus efficaces.
"Il y a beaucoup de, de nombreuses raisons pour lesquelles il s'agit d'une recherche passionnante, dont le moindre est que vous pouvez fondamentalement faire une molécule et vous pouvez dire, peut-être que j'aimerais vraiment changer ce stéréocentre pour en faire quelque chose d'autre. Vous pouvez réellement revenir en arrière et le faire, " a déclaré David MacMillan, le James S. McDonnell Distinguished University Professor of Chemistry. "C'est quelque chose que nous ne pensons pas avoir vraiment été fait de cette façon auparavant en chimie organique et cela ouvre donc des opportunités remarquables."
Les enzymes boostent les résultats
C'est l'introduction d'enzymes hautement sélectives dans le processus qui a fait progresser l'enquête de la recherche « B+ à A+ », dit MacMillan.
"Les enzymes ont cette façon de transmettre ce qu'on appelle le stéréocontrôle, ou introduire des formes très spécifiques pour faire de la chimie que les catalyseurs ordinaires ne peuvent tout simplement pas faire, " dit-il. " En rassemblant ces deux idées, cela permet une approche complètement nouvelle de la façon dont vous construisez la stéréochimie."
Il se passe beaucoup de choses sous le capot dans ce processus. Lorsque les scientifiques synthétisent un composé avec plusieurs stéréocentres, ils font l'hypothèse que le centre ne peut pas basculer ou devenir dynamique une fois qu'il est « fixé ». Les molécules sont synthétisées séquentiellement :un centre se forme, et puis c'est verrouillé; et puis un autre se forme, et puis c'est verrouillé, etc.
Jacob DeHovitz, un étudiant diplômé de cinquième année au laboratoire Hyster et auteur principal de l'article, a expliqué comment la réaction décrite dans cette recherche permet aux scientifiques de déverrouiller ce paramètre.
Il y a deux parties importantes à la réaction. Dans la première moitié, deux espèces clés sont formées à partir d'un matériau de départ cétonique. La première espèce s'appelle une énamine, clé car il peut être ciblé par le catalyseur photoredox. Une seconde espèce, un radical énaminyle, résulte de cette étape, et détruit le stéréocentre moléculaire d'origine et met en place la prochaine étape du processus.
"La seconde moitié est la réaction biocatalytique. L'enzyme en solution - dans ce cas, principalement des cétoréductases - réduit l'un de ces énantiomères cétoniques, qui à nouveau racémisent constamment en solution, pour former un produit alcoolique qui ne peut pas subir de racémisation dans nos conditions. De manière critique, l'autre énantiomère cétonique ne réagit pas avec la cétoréductase car il ne peut pas s'insérer dans le site actif de l'enzyme. Ce biais pour un énantiomère est important car il empêche la cétoréductase de la formation indésirable d'autres stéréoisomères d'alcool.
« Si la réaction biocatalytique est combinée aux nouvelles conditions de racémisation dans lesquelles les énantiomères du matériau de départ sont en constante racémisation, alors un chimiste peut théoriquement s'offrir jusqu'à 100% du produit souhaité, doubler l'efficacité, " a déclaré DeHovitz.
Cette recherche représente trois années d'investigation collaborative par les deux laboratoires.