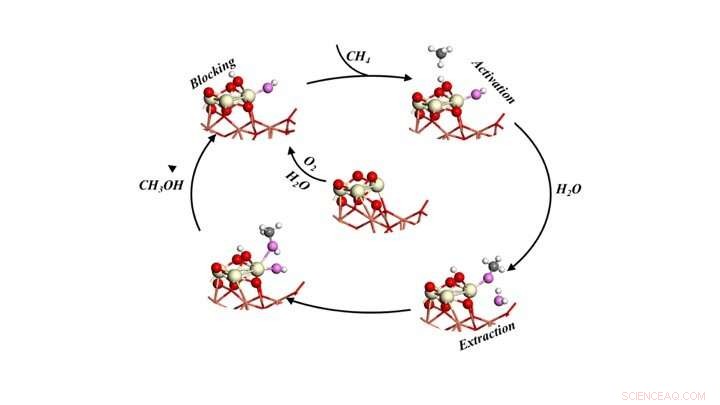
Cycle catalytique pour convertir sélectivement le méthane en méthanol en exposant le méthane à l'oxygène et à l'eau. Crédit :Laboratoire national de Brookhaven
Des scientifiques du laboratoire national de Brookhaven du département américain de l'Énergie et des collaborateurs ont révélé de nouveaux détails qui expliquent comment un catalyseur hautement sélectif convertit le méthane, principal composant du gaz naturel, au méthanol, un combustible liquide et une matière première faciles à transporter pour la fabrication de matières plastiques, des peintures, et d'autres produits de base. Les résultats pourraient aider à la conception de catalyseurs encore plus efficaces/sélectifs pour faire de la conversion du méthane une alternative économiquement viable et attrayante pour l'environnement à la ventilation ou au torchage des gaz « déchets ».
Comme décrit dans un article paru dans Science , l'équipe a utilisé des modèles et des simulations basés sur la théorie pour identifier les réarrangements au niveau atomique qui ont lieu pendant la réaction, puis mené des expériences pour vérifier ces détails. Les études ont révélé trois rôles essentiels pour l'eau, travaillant en conjonction avec un catalyseur économique d'oxyde de cérium/oxyde de cuivre, pour provoquer la conversion du méthane en méthanol avec une sélectivité de 70 pour cent tout en bloquant les réactions secondaires indésirables.
"Nous savions par des travaux antérieurs que nous avions développé un catalyseur hautement sélectif pour la conversion directe du méthane en méthanol en présence d'eau, " a déclaré le chimiste du Brookhaven Lab, Sanjaya Senanayake, qui a mené le projet. "Mais maintenant, en utilisant des techniques théoriques et expérimentales avancées, nous avons appris pourquoi cela fonctionne si bien."
Les résultats pourraient accélérer le développement de catalyseurs utilisant le méthane s'échappant des puits de gaz et de pétrole, où il est généralement évacué directement dans l'atmosphère ou brûlé.
"Le transport de gaz est extrêmement difficile et potentiellement dangereux, " a déclaré Senanayake. "Mais si vous le convertissez directement en liquide, vous pouvez le déplacer et l'utiliser au lieu de le brûler inutilement. Bien que le potentiel de commercialisation d'une telle réaction puisse encore prendre plusieurs années, nous espérons que nos résultats et la compréhension de la façon dont tout cela fonctionne nous aideront à y arriver plus rapidement."
La théorie jette les bases
La recherche de catalyseurs méthane-méthanol a ouvert quelques perspectives prometteuses. Mais beaucoup fonctionnent en plusieurs étapes distinctes avec des besoins énergétiques élevés. Et dans de nombreux cas, des réactions concurrentes décomposent complètement le méthane (et tout méthanol produit) en monoxyde de carbone (CO) et en CO2. Donc, lorsque l'équipe de Brookhaven a observé pour la première fois que leur catalyseur pouvait convertir directement le méthane en méthanol avec un rendement élevé en une seule réaction continue, ils voulaient en savoir plus sur la façon dont il s'acquittait de cette tâche difficile.
Ils étaient particulièrement intéressés à comprendre le rôle de l'eau, qui semblait faciliter les étapes clés du processus et bloquer d'une manière ou d'une autre les voies de réaction qui ont produit du CO et du CO2.
À l'aide d'outils informatiques du Brookhaven Lab's Center for Functional Nanomaterials (CFN), Centre de données scientifiques et de calcul de Brookhaven, Université Stony Brook (SBU), et le National Energy Research Scientific Computing Center (NERSC) au Lawrence Berkeley National Laboratory du DOE (Berkeley Lab), Le chimiste de Brookhaven Ping Liu a développé l'approche théorique pour comprendre ce qui se passait.
D'abord, elle a utilisé des calculs de la "théorie fonctionnelle de la densité" (DFT) pour identifier comment les réactifs (méthane, oxygène, et l'eau) ont changé au fur et à mesure qu'ils interagissaient les uns avec les autres et avec le catalyseur d'oxyde de cérium/oxyde de cuivre à divers stades de la réaction. Ces calculs comprenaient également des informations sur la quantité d'énergie qu'il faudrait pour passer d'un arrangement atomique au suivant.
« Le DFT vous donne un tas d'« instantanés » des étapes impliquées dans la réaction et les « bosses » ou les barrières que vous devez surmonter pour passer d'une étape à l'autre, " elle a expliqué.
Ensuite, elle a effectué des simulations de « Monte Carlo cinétique », utilisant essentiellement des ordinateurs pour essayer toutes les manières possibles dont la réaction pouvait se dérouler d'un instantané à l'autre. Les simulations prennent en compte toutes les voies possibles et les besoins énergétiques pour passer d'une étape à l'autre.
"Ces simulations commencent à chaque étape intermédiaire et examinent toutes les possibilités qui peuvent aller à l'étape suivante - et déterminent quelle est la voie la plus probable, " a déclaré Liu. " Les simulations déterminent la manière la plus probable de connecter les instantanés en temps réel. "
Les simulations modélisent également comment différentes conditions de réaction, par exemple, les changements de pression et de température affecteront les vitesses de réaction et les voies probables.
"Il y avait 45-50 composants possibles dans le 'réseau de réaction' que nous simulions, " a déclaré José Rodriguez, un chef du groupe de catalyse de Brookhaven qui a également un rendez-vous conjoint à SBU. « Parmi ceux-ci, Ping, Erwei Huang, et Wenjie Liao, deux doctorats étudiants à la SBU, ont pu prédire quelles seraient les conditions les plus favorables, le meilleur chemin, pour passer du méthane au méthanol et non au CO et au CO2 - et tout cela induit par la présence d'eau."
Les modèles ont prédit trois rôles pour l'eau :1) activer le méthane (CH4) en brisant une liaison carbone-hydrogène et en fournissant un groupe -OH pour convertir le fragment CH3 en méthanol, 2) bloquer les sites réactifs qui pourraient potentiellement convertir le méthane et le méthanol en CO et CO2, et 3) facilite le déplacement du méthanol formé à la surface dans la phase gazeuse en tant que produit.
« Toute l'action se déroule sur un ou deux sites actifs à l'interface entre les nanoparticules d'oxyde de cérium et le film d'oxyde de cuivre qui composent notre catalyseur, " a déclaré Senanayake.
Mais cette description n'était encore qu'un modèle. Les scientifiques avaient besoin de preuves.

Brookhaven Lab et Stony Brook University (SBU) membres de l'équipe de recherche. Première rangée, de gauche à droite :Sanjaya Senanayake (Brookhaven), Mausumi Mahapatra (Brookhaven), José A Rodriguez (Brookhaven), Ping Liu (Brookhaven) et Wenjie Liao (SBU). Deuxième rangée :Ivan Orozco (SBU), Ning Rui (Brookhaven), Zongyuan Liu (Brookhaven) et Erwei Huang (SBU). Crédit :Laboratoire national de Brookhaven
Les expériences apportent la preuve
Pour recueillir des preuves, les scientifiques de Brookhaven et de la SBU ont mené des expériences supplémentaires dans les laboratoires de la division de chimie de Brookhaven et ont effectué plusieurs voyages à la source lumineuse avancée (ALS) du laboratoire de Berkeley. Cette équipe comprenait SBU Ph.D. l'étudiant Ivan Orozco et les boursiers postdoctoraux Zongyuan Liu, Robert M. Palomino, Ning Rui, et Mausumi Mahapatra.
A l'ALS, le groupe a travaillé avec Slavomir Nemsak du Berkeley Lab et ses collaborateurs Thomas Duchon (Peter-Grünberg-Institut en Allemagne) et David Grinter (Diamond Light Source au Royaume-Uni) pour réaliser des expériences utilisant la spectroscopie photoélectronique à rayons X (XPS) à pression ambiante (AP) , ce qui leur a permis de suivre la réaction en temps réel pour identifier les étapes clés et les intermédiaires.
"Les rayons X excitent les électrons, et l'énergie des électrons vous indique quelle espèce chimique vous avez à la surface et l'état chimique de l'espèce. Il fait une 'empreinte chimique'. ", a déclaré Rodriguez. "En utilisant cette technique, vous pouvez suivre la chimie de surface et le mécanisme de réaction en temps réel."
L'exécution de la réaction avec et sans eau dans une gamme de conditions a confirmé que l'eau jouait les trois rôles prédits. Les mesures ont montré comment les conditions de réaction faisaient avancer le processus et maximisaient la production de méthanol en empêchant les réactions secondaires.
"Nous avons trouvé des preuves directes de la formation de CH3O - un précurseur intermédiaire du méthanol - en présence d'eau, " dit Rodriguez. " Et parce que tu as l'eau, vous modifiez toute la chimie de surface pour bloquer les réactions secondaires, et aussi facilement libérer le méthanol de la surface du catalyseur afin qu'il ne se décompose pas."
« Maintenant que nous avons identifié les principes de conception du catalyseur, " Senanayake a dit, "Ensuite, nous devons construire un véritable système pour utiliser un tel catalyseur et le tester - et voir si nous pouvons l'améliorer."