Tableau des composés pertinents pour la présente étude. Crédit: Avancées scientifiques , doi:10.1126/sciadv.aaz3168
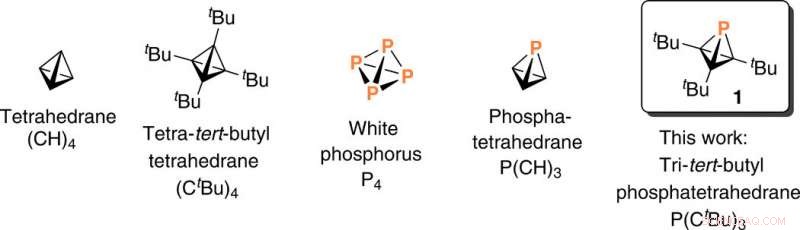
Une équipe de recherche du département de chimie du Massachusetts Institute of Technology (MIT), Cambridge États-Unis, ont exploré une voie de synthèse pour générer une charpente phosphatetraédrane. Pendant la voie synthétique, l'équipe a remplacé un seul sommet de carbone par un autre élément de bloc p dans une molécule de tétraèdre fortement sollicitée. Les molécules fortement sollicitées possèdent des angles de liaison inhabituellement aigus au niveau du carbone et sont des espèces de haute énergie. Afin de remplacer un seul sommet de carbone pour moins de contrainte dans ce travail, Martin-Louis Y. Riu et ses collègues ont sélectionné le phosphore en raison de sa stabilité, forme moléculaire tétraédrique. Ils ont accompli la tâche par déhydrofluoration de la fluorophosphine [H(F)P(C
t
Bu)
Les cages tendues telles que le tétraèdre sont des composants structurels intéressants utilisés pour concevoir de nouveaux matériaux à haute densité énergétique. Bien que la molécule de tétraèdre parent soit restée insaisissable, c'est une cible viable et les chimistes visent à isoler avec succès des molécules contenant le noyau tétraédrique à quatre atomes de carbone et à l'enfermer avec des substituants pour synthétiser de nouveaux matériaux. Dans une approche complémentaire, les chercheurs peuvent substituer d'autres éléments dans le noyau tétraédrique, notamment le phosphore, connue sous le nom de "copie carbone" en raison de son approximation du carbone - basée sur l'électronégativité et la capacité de former des liaisons multiples - qui constitue la base de la chimie organique phospha. Dans les systèmes organiques fortement sollicités où les molécules contiennent des angles de liaison anormalement aigus au niveau du carbone, Riu et al. remplacé un atome de carbone du tétraèdre par du phosphore pour donner une entité moléculaire stable. Le potentiel de créer un phosphatetraèdre est logique en raison de la nature tétraédrique du P
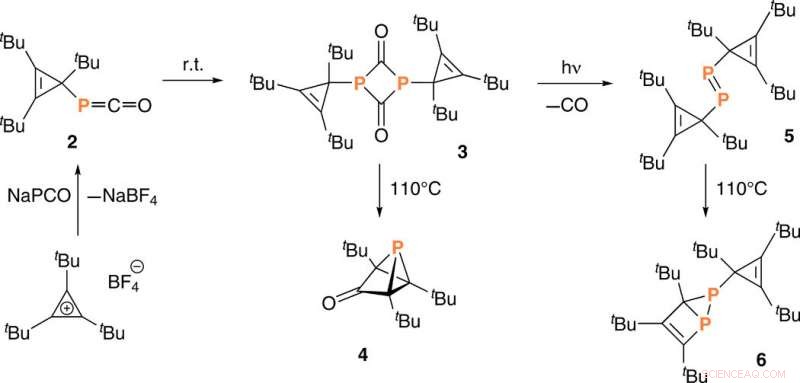
Synthèse du phosphacétène 2, diphosphène 5, et les analogues phosphorés de la tricyclopentanone 4 et du housene 6. r.t., température ambiante. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz3168
Étant donné que la substitution de groupes volumineux est essentielle pour stabiliser (CR)
Après de brèves périodes d'irradiation, ils ont produit une espèce contenant un signal de résonance magnétique nucléaire (RMN) 31P, qu'ils ont identifié comme un composant de la molécule de phosphatetrahédrane souhaitée (appelée composé 1) dans un mélange complexe. Des périodes d'irradiation prolongées ont entraîné une perte du signal RMN à champ élevé intrigant qui représentait le produit, tout en montrant une complexité accrue du mélange réactionnel. Étant donné que les halogénures (chlorure, bromure, fluorure) peut également induire l'élimination de l'anthracène, l'équipe a étudié une stratégie alternative pour générer HXP(C
t
Bu)
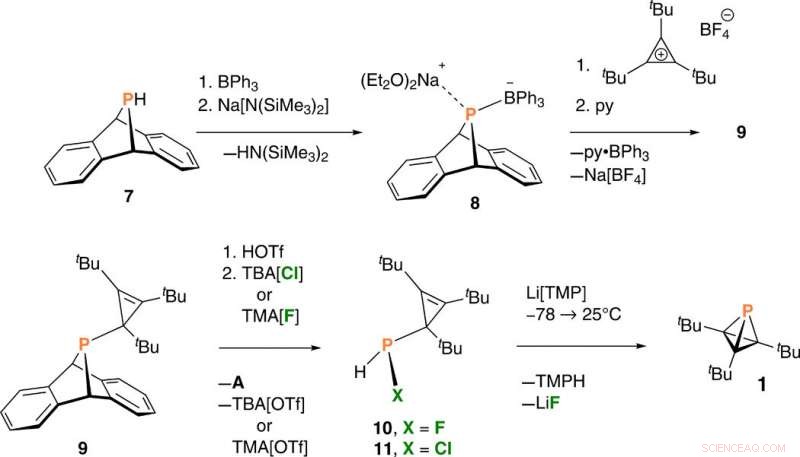
Synthèse du tri-tert-butyl phosphatetrahédrane 1. TBA, tétra-n-butylammonium; TMA, tétraméthylammonium; TMP, tétraméthylpipéridide; TMPH, tétraméthylpipéridine. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz3168
La déshydrohalogénation du composé 10 –fluorophosphine était efficace et reproductible pour produire du phosphatetraédrane (composé 1) – la structure d'intérêt. L'équipe a optimisé le protocole pour fournir le composé 1 en tant que produit principal et a caractérisé le résultat avec des signaux RMN pour confirmer sa pureté/identité. Riu et al. d'abord obtenu des échantillons bruts du produit phosphatetraédrane sous la forme d'une huile jaune pâle, qu'ils ont purifiés à travers un tampon de silice pour fournir des échantillons solides incolores. Ils ont ensuite attribué le faible rendement du composé isolé à la volatilité pendant l'isolement et la purification.
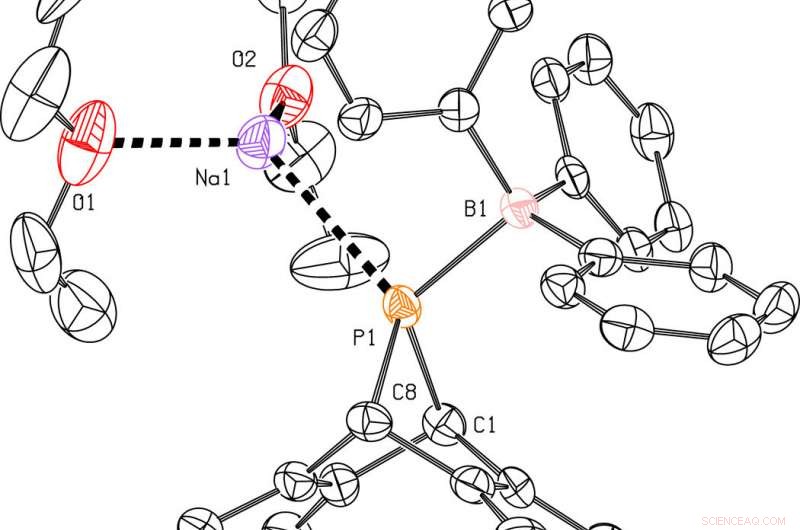
Structures moléculaires d'intermédiaires clés obtenues à partir d'expériences de diffraction des rayons X sur monocristal. (A) Dessin de Na[8] avec des ellipsoïdes thermiques montrés au niveau de probabilité de 50 %. Les atomes d'hydrogène ont été omis. (B) Dessin du composé 9 avec des ellipsoïdes thermiques montrés au niveau de probabilité de 50 %. Les atomes d'hydrogène ont été omis. Avancées scientifiques, doi:10.1126/sciadv.aaz3168
Les scientifiques ont finalement fait pousser des cristaux du produit d'intérêt—le phosphate de phosphatédrane pour les études de diffraction des rayons X et ont utilisé la sublimation pour surmonter la volatilité et faciliter le développement du produit. En utilisant les données, ils ont déterminé la structure du phosphatetraédrane, ce qui était bien en accord avec ceux prédits à l'aide de calculs de chimie quantique. Le composé final a montré une stabilité thermique et une stabilité considérables dans l'air (à température ambiante) pendant une demi-heure, bien qu'ils soient instables sous une irradiation ultraviolette de 254 nm. Riu et al. utilisé des calculs de chimie quantique pour éclairer la liaison et expliqué la stabilité de la structure moléculaire, tout en illustrant comment trois substitutions volumineuses étaient suffisantes pour produire un tétraèdre isolé.
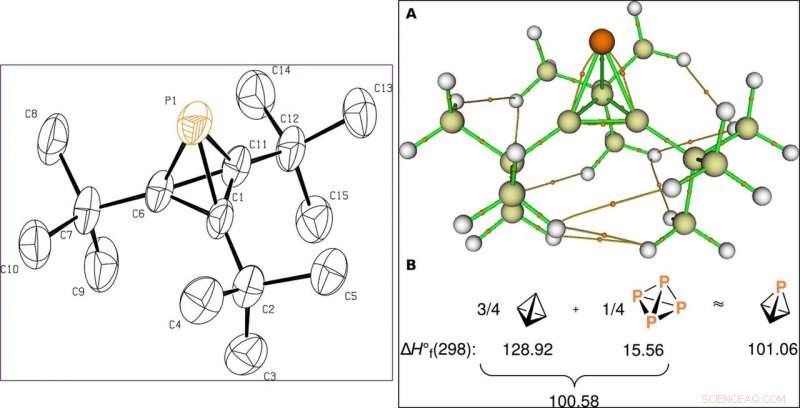
GAUCHE :Dessin structurel du phosphate de tri-tert-butyle 1 à partir d'une expérience de diffraction des rayons X sur un seul cristal. Les ellipsoïdes thermiques sont affichés au niveau de probabilité de 50 %, et les atomes d'hydrogène ont été omis. DROITE :Analyse de la liaison dans le composé 1 à l'aide de calculs de chimie quantique. (A) Graphique moléculaire de P(CtBu)3 (1) montrant les chemins reliant des paires d'atomes liés, coller les points critiques sous forme de petites sphères oranges, l'atome de phosphore comme une grande sphère orange, atomes de carbone sous forme de sphères beiges, et des atomes d'hydrogène sous forme de sphères blanches. (B) Chaleurs étalons de formation en kcal/mol à 298,15 K pour le tétraèdre, P4, et phosphatetraédrane de G3(MP2, Calculs CCSD(T)) effectués à l'aide du progiciel de chimie quantique GAMESS. La valeur du phosphatetraèdre ΔH∘f peut être approchée comme la somme des trois quarts de la valeur du tétraèdre et du quart de la valeur de la molécule P4. Avancées scientifiques, doi:10.1126/sciadv.aaz3168
De cette façon, Martin-Louis Y. Riu et ses collègues ont synthétisé des tri- tert -butyl phosphatetrahédrane pour produire la preuve de l'existence d'une molécule avec la plus petite somme d'angles de liaison concevable pour un atome de phosphore trivalent. Pour réussir la synthèse du phosphatetraédrane, l'équipe s'est appuyée sur une nouvelle chimie de réaction des phosphinidénoïdes qui reste à expliquer en détail mécanique. La stratégie décrite dans ce travail sera applicable à d'autres cibles synthétiques tendues.
© 2020 Réseau Science X