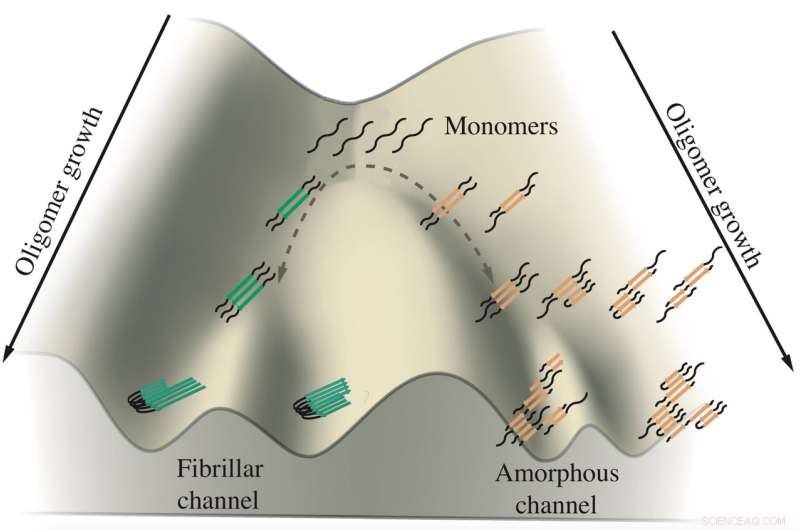
Un schéma montre la croissance d'oligomères tau impliqués dans les maladies d'Alzheimer et de Pick. Les monomères de tau ont tendance à s'agréger le long de deux canaux, l'une conduisant à des fibrilles qui forment des enchevêtrements et l'autre à des amas amorphes dans les neurones. Les chercheurs de l'Université Rice ont simulé les protéines dans des modèles informatiques pour voir comment et où la ramification se produit. Crédit :Centre de physique biologique théorique
De nouvelles simulations réalisées par des scientifiques de l'Université Rice racontent l'histoire de deux taus et leur lien avec les maladies neurologiques.
Leurs travaux suggèrent que les protéines tau empruntent l'une des deux voies pour former des agrégats suspectés de favoriser, et peut-être provoquant, Maladies d'Alzheimer et de Pick (alias démence frontotemporale). Précisément pourquoi reste un mystère, mais le découvrir offre la possibilité de contrôler leur destin.
protéines Tau, en particulier dans les neurones, régulent principalement les microtubules, les filaments qui servent de routes pour les marchandises à l'intérieur d'une cellule et facilitent la division. Mais ils se présentent sous de nombreuses formes et, comme il s'avère, ceux-ci peuvent s'agréger de différentes manières.
L'étude du biophysicien Peter Wolynes et de son équipe dans le Actes de l'Académie nationale des sciences est la première analyse informatique à établir une distinction entre les protéines qui forment soit les fibrilles solides trouvées dans le cerveau des patients atteints de la maladie d'Alzheimer et de la maladie de Pick, soit des malades, des amas ressemblant à des tumbleweed qui flottent dans le cytoplasme des neurones.
"Il y a une relation entre la forme qui se transforme en organites sans membrane (les tumbleweeds) et la forme qui devient fibres, " dit Wolynes, co-directeur du Rice's Center for Theoretical Biological Physics. "Il semble y avoir deux voies distinctes que la même molécule de tau peut suivre, et l'équilibre entre les deux voies est affecté par un processus biologique."
Il a dit que les modèles suggèrent que la phosphorylation, qui régule de nombreux processus de signalisation cellulaire, peut être le facteur déterminant.
« Une fois que nous aurons déterminé lequel de ces agrégats est le véritable méchant, alors il devrait être possible d'intervenir dans, dire, le processus de phosphorylation lui-même afin de modifier l'équilibre, " a déclaré Wolyne.
Le laboratoire Rice a utilisé son AWSEM à gros grains (mémoire associative, à médiation par l'eau, structure et modèle énergétique) outil d'analyse, qui prédit comment les protéines se replient, sur une variété de modèles de protéines tau basés sur des variantes de patients. Ils ont découvert que la formation de fibres peut être manipulée par phosphorylation qui se produit à une multitude de sites dans la protéine tau.
"Nous avons trouvé que la phosphorylation encourageait la formation de l'agrégat amorphe, mais cela n'a pas encouragé la formation de la fibre - par autant, De toute façon, " a déclaré Wolyne.
La phosphorylation peut également dérailler, il a dit. "Il y a quelque chose comme 20 sites le long de la protéine tau qui peuvent être phosphorylés, mais en général, seulement quatre ou cinq d'entre eux le sont, " dit Wolynes. " Mais parfois, ils sont devenus hyperphosphorylés, ce qui signifie que les enzymes responsables du processus en font plus. Ils finissent par, dire, 10 sites phosphorylés au lieu de cinq, et cela peut avoir un certain effet.
"Si la phosphorylation supplémentaire peut causer plus de la maladie, nous voudrions découvrir quelles kinases font la phosphorylation et essayer de les inhiber avec un médicament, comme nous le faisons dans le traitement du cancer, " il a dit.
Les protéines Tau présentaient une autre caractéristique intéressante appelée backtracking, que les chercheurs ont vu dans les peptides bêta-amyloïdes qui sont également impliqués dans la maladie d'Alzheimer. Les deux ont tendance à s'agréger jusqu'à ce que des barrières énergétiques les forcent à se déployer partiellement puis à chercher un autre chemin vers leur final, formes les plus stables.
C'est à ce stade de frustration que l'agrégation de taus semble se ramifier dans différentes directions, dit Wolyne. Un ensemble de tau forme des fibrilles parallèles qui s'agrègent en plaques ordonnées observées dans le cerveau des patients, tandis que l'autre s'agrège de manière lâche dans la touffe flottante. Les chercheurs ont suggéré que le mécanisme de retour en arrière pourrait être une caractéristique universelle de l'agrégation des protéines, un sujet d'étude future.
Les agrégats lâches présentent leurs propres défis aux scientifiques, dit Wolyne.
"C'est une question de physique dans le sens suivant :ce sont des objets localisés, mais pourquoi ne s'assemblent-ils pas tous et ne forment-ils pas un énorme organite, comme ce qui se passe avec les gouttes d'huile dans l'eau ? » dit-il. « Est-ce juste qu'il leur faut trop de temps pour se déplacer ? Est-ce qu'ils sont constamment fabriqués et démontés? Et qu'est-ce qui détermine leur taille?
"À ce point, ça reste une histoire très basique et assez simple, " dit Wolynes. " L'histoire réelle de tau est encore trop compliquée pour nous, mais ce que nous avons appris jusqu'à présent est assez simple."