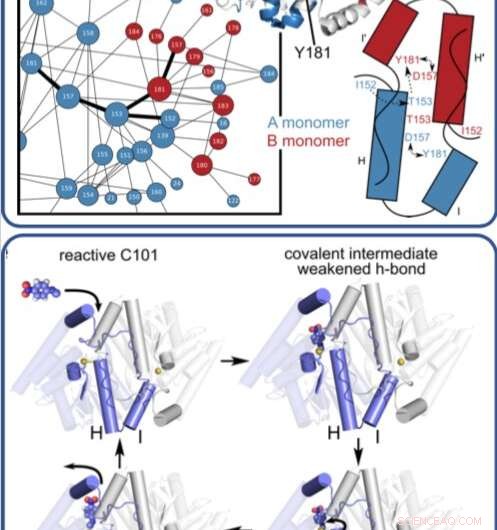
Cette illustration montre comment une enzyme se déplace et change lorsqu'elle catalyse des réactions complexes et décompose les composés organiques. Crédit: Actes de l'Académie nationale des sciences
Dans une expérience aux rayons X résolue en temps, chercheurs découverts, à résolution atomique et en temps réel, la manière jusque-là inconnue dont une enzyme microbienne décompose les composés organiques.
L'équipe, dirigé par Mark Wilson à l'Université du Nebraska Lincoln (UNL) et Henry van den Bedem au SLAC National Accelerator Laboratory du Department of Energy (maintenant chez Atomwise Inc.), ont publié leurs conclusions la semaine dernière dans le Actes de l'Académie nationale des sciences . Ce qu'ils ont appris sur cette enzyme, dont la structure est similaire à celle qui est impliquée dans les maladies neurodégénératives telles que la maladie de Parkinson, pourrait conduire à une meilleure compréhension de la façon dont les antibiotiques sont décomposés par les microbes et au développement de médicaments plus efficaces.
Précédemment, les chercheurs ont utilisé la source lumineuse de rayonnement synchrotron de Stanford (SSRL) du SLAC pour obtenir la structure de l'enzyme à très basse température en utilisant la cristallographie aux rayons X. Dans cette étude, Medhanjali Dasgupta, un étudiant diplômé de l'UNL qui était le premier auteur de l'étude, utilisé la source de lumière cohérente Linac (LCLS), Le laser à rayons X du SLAC, de regarder l'enzyme et son substrat dans le cristal se déplacer et changer au cours d'un cycle catalytique complet à température ambiante.
Les scientifiques ont utilisé un logiciel spécial, conçu par van den Bedem, qui est très sensible à l'identification du mouvement des protéines à partir des données de cristallographie aux rayons X pour interpréter les résultats, révélant des mouvements inédits qui jouent un rôle clé dans la catalyse de réactions complexes, comme la décomposition des antibiotiques. Prochain, les chercheurs espèrent utiliser le LCLS pour obtenir les structures à température ambiante d'autres enzymes afin de mieux comprendre comment les mouvements qui s'y produisent aident à faire avancer les réactions.