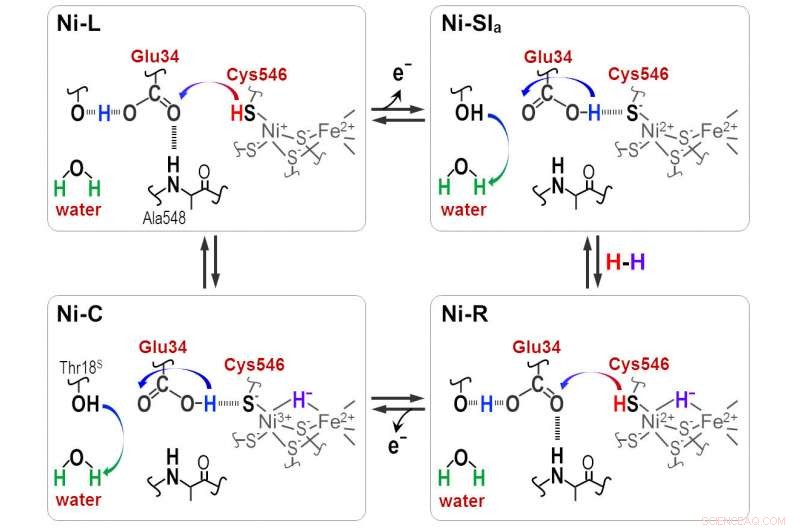
Les protons sont transférés entre le site actif NiFe et la protéine environnante à travers les résidus Cyt546 et Glu34 au cours de la réaction catalytique de l'hydrogénase [NiFe]. Crédit :Shun Hirota
Pour toutes les avancées technologiques réalisées tout au long de notre vie, dans de nombreux cas, il soutient ce que la nature peut faire. Les fourmis peuvent porter 5000 fois leur poids, et les toiles d'araignées sont cinq fois plus résistantes que l'acier. L'efficacité énergétique n'est pas différente. Dans un nouveau haras à Angewandte Chemie Édition Internationale , des chercheurs de l'Institut des sciences et technologies de Nara (NAIST) rapportent de nouveaux détails sur la voie de transfert de protons du nickel-fer [NiFe]-hydrogénase à l'aide de la spectroscopie infrarouge à transformée de Fourier (FTIR). Ce transfert est crucial pour le métabolisme de l'hydrogène des microorganismes, et l'étude permet aux scientifiques de mieux comprendre comment imiter la nature dans la construction de nouvelles piles à biocarburant.
Le métabolisme de l'hydrogène est l'une des formes les plus anciennes de production d'énergie pour la vie et l'une des plus étudiées en raison de son importance dans l'évolution. Il a également attiré l'attention car il s'agit d'une source d'énergie propre. Parmi les enzymes responsables du métabolisme de l'hydrogène, La [NiFe]-hydrogénase est la plus abondante et la plus ancienne.
On en sait beaucoup sur l'enzyme. Il oxyda de manière réversible les atomes d'hydrogène à travers son site actif Ni-Fe, qui est entouré d'acides aminés spécifiques. Cependant, note le professeur NAIST Shun Hirota, qui a dirigé l'étude, certains principes fondamentaux des réactions chimiques doivent être compris avant d'utiliser cette nanomachine pour concevoir des technologies de biocarburants.
"Hydrure et proton se coordonnent avec le site Ni-Fe dans le cycle protonation-déprotonation, résultant en quatre états d'hydrogénase. Mais la voie de transfert des protons reste inconnue, " il dit.
L'une des raisons du manque de clarté a été l'incapacité à résoudre les fréquences d'étirement des différentes liaisons hydrogène. Dans le nouveau travail, L'équipe d'Hirota, en collaboration avec d'autres chercheurs au Japon et en Chine, résolu ce problème en observant les photoconversions de trois états d'hydrogénase avec des spectres FTIR.
L'hydrogénase catalyse l'oxydation réversible de H2. Crédit :Shun Hirota
Des fréquences d'absorbance distinctes ont révélé que l'une des quatre cystéines, cystéine 546, avec un autre acide aminé, acide glutamique 34, et une molécule d'eau ordonnée sont cruciales pour le transfert. Les scientifiques ont utilisé les nouvelles informations pour déduire comment la molécule de soufre de la cystéine 546 et le groupe acide de l'acide glutamique 34 forment des liaisons hydrogène pour réguler le transport de l'hydrogène.
"Nos résultats montrent que la cystéine 546 est un donneur et un accepteur de protons dans le cycle de l'hydrogénase [Ni-Fe]. Ils démontrent également comment une liaison hydrogène à faible barrière pour l'acide glutamique 34 est formée et clivée pendant le cycle catalytique, " note Hirota.
Les micro-organismes se sont adaptés à un plus large éventail de conditions environnementales que les humains. On les retrouve dans le climat confortable de nos chambres aux environnements les plus hostiles de la planète. Ainsi, voir comment le site [Ni-Fe] de l'hydrogénase [Ni-Fe] transfère les protons de manière optimale fournit un paradigme pour les chercheurs cherchant à fabriquer des catalyseurs énergétiques à haut rendement dans une multitude de conditions.
"La vie a passé des milliards d'années à s'adapter à l'énergie. Nous pensons que cela nous donne le meilleur modèle d'efficacité énergétique à l'avenir, " dit Hirota.