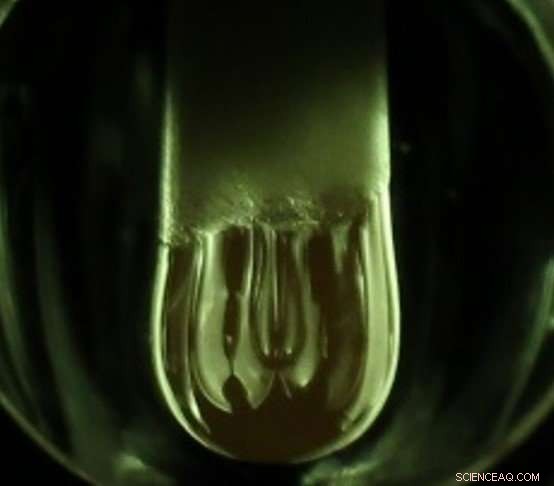
Une gouttelette en fusion suspendue, ou pendentif (au centre), se forme à partir d'une tige d'oxyde d'aluminium sous la chaleur intense et la lumière des lampes au xénon. En utilisant ce processus, Des chercheurs du MIT ont démontré une nouvelle méthode électrochimique pour étudier les processus thermodynamiques dans un bain d'oxyde fondu à des températures supérieures à 2, 000 degrés Celsius. Crédit :Melody M. Wang
Les propriétés thermodynamiques de composés tels que l'oxyde d'aluminium, qui sont dits réfractaires car ils fondent à des températures supérieures à 2, 000 degrés Celsius (3, 632 degrés Fahrenheit), ont été difficiles à étudier car peu de vaisseaux peuvent supporter la chaleur pour les contenir, et ceux qui réagissent souvent avec la fonte et la contaminent.
Les chercheurs du MIT présentent maintenant une méthode électrochimique sans conteneur pour étudier les propriétés thermodynamiques de ces hot melts dans un article publié dans le Journal de la société électrochimique .
"Nous avons une nouvelle technique qui démontre que les règles de l'électrochimie sont suivies pour ces fontes réfractaires, " dit l'auteur principal Antoine Allanore, professeur agrégé de métallurgie. "Nous avons maintenant la preuve que ces fontes sont très stables à haute température, ils ont une conductivité élevée."
Adaptation d'un four d'imagerie thermique (ou imagerie à arc) plus couramment utilisé pour la croissance cristalline en zone flottante, Brad Nakanishi, étudiant diplômé du MIT, a fait fondre une tige d'alumine (oxyde d'aluminium) et a contacté la gouttelette liquide pendante qu'elle a formée avec des électrodes, créer une cellule électrochimique qui a permis la décomposition de pur, électrolyte d'alumine en oxygène gazeux et alliage d'aluminium par électrolyse pour la première fois. L'oxyde d'aluminium lui-même sert d'électrolyte dans cette cellule électrochimique, qui fonctionne de manière similaire à l'électrolyse de l'eau.
"Les mesures de tension de décomposition nous donnent un accès direct à la propriété thermodynamique par excellence qu'est le potentiel chimique, aussi appelée énergie de Gibbs, " explique Nakanishi. " Nous avons montré que nous effectuons des mesures électrochimiques dans une nouvelle classe d'électrolytes, les oxydes réfractaires fondus."
Le changement dans cette énergie de Gibbs, ou potentiel chimique, par rapport à la température est connue sous le nom d'entropie. "A haute température, l'entropie est vraiment importante et très difficile à prédire, donc avoir la capacité de mesurer l'entropie dans ces systèmes est la clé, " dit Nakanishi.
Une gouttelette suspendue
En utilisant cette technique, quatre lampes au xénon réfléchies se concentrent sur la pointe de l'échantillon, faire fondre une gouttelette de liquide, qui est maintenu à la tige par tension superficielle et se solidifie rapidement une fois les lumières éteintes. Pendant que la goutte est liquéfiée, les électrodes sont remontées dans la goutte pour compléter un circuit électrique, avec l'alumine liquide elle-même fonctionnant comme électrolyte.
"C'est quelque chose que nous n'avons pas vu faire autrement, également, faire de l'électrochimie dans une goutte en suspension au-dessus de 2, 000 C, " dit Nakanishi.
La gouttelette suspendue a une tension superficielle élevée par rapport à sa densité.
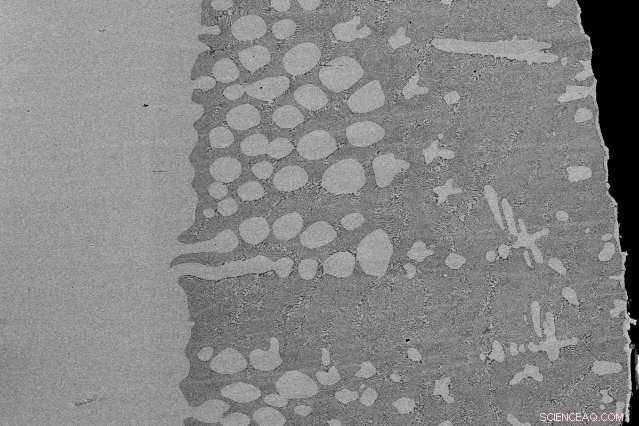
En adaptant un four d'imagerie thermique plus couramment utilisé pour la croissance des cristaux, Bradley Nakanishi, étudiant diplômé du MIT, a fait fondre une tige d'oxyde d'aluminium et a contacté le pendentif liquide suspendu qu'il a formé avec des électrodes, permettant la décomposition par électrolyse du matériau en oxygène gazeux et alliage d'aluminium pour la première fois. Ici, une micrographie électronique rétrodiffusée montre la variation de composition et de microstructure le long d'une coupe verticale de la cathode après électrolyse. Un dépôt liquide d'alliage aluminium-iridium (au centre à droite) se forme à l'interface entre la cathode d'iridium (à gauche) et l'électrolyte (zone noire, extrème droite). Crédit :Bradley Nakanishi
"La concentration de l'énergie lumineuse, zone chaude, et de grands gradients thermiques présents, nous permet de manière très contrôlée de créer une situation pour un contact stable des gouttelettes et des électrodes, " dit Nakanishi. " Cela semble difficile, mais la méthode que nous avons affinée est simple et rapide à mettre en œuvre grâce à la pratique, en partie, à une caméra permettant l'observation continue de la gouttelette et des électrodes pendant l'expérience."
Allanore dit que la stabilité de l'oxyde d'aluminium liquide et un choix judicieux de matériaux d'électrode permettent de mesurer des niveaux d'énergie bien définis.
"L'article montre que nous pouvons maintenant mesurer les propriétés thermodynamiques fondamentales d'un tel bain, " dit Allanore. " Dans le cas de l'alumine fondue, nous avons effectivement pu étudier la propriété du produit cathodique. Comme nous décomposons l'oxyde d'aluminium, à l'oxygène d'un côté [anode] et à l'aluminium de l'autre [cathode], alors que l'aluminium liquide interagit avec l'électrode, qui était de l'iridium dans ce cas, " il dit.
La vidéo de la cellule en fonctionnement montre des bulles d'oxygène gazeux se formant à l'intérieur de la cellule lorsque l'alumine se décompose en aluminium à la cathode (l'électrode chargée négativement) et en oxygène pur à l'anode en iridium (l'électrode chargée positivement). L'aluminium interagit avec la cathode d'iridium, ce qui est confirmé par la fusion partielle et les images post-expérimentales de la microstructure montrant un dépôt d'alliage aluminium-iridium.
"Nous pouvons maintenant calculer la propriété thermodynamique de cet alliage, de cette interaction, ce qui n'a jamais été mesuré auparavant. Il a été calculé et prévu. Il n'a jamais été mesuré. Ici, dans cet article, nous confirmons réellement les prédictions du calcul en utilisant notre méthode, " dit Allanore.
De nouveaux pouvoirs prédictifs
Pour les questions industrielles clés, comme la température à laquelle un moteur à turbine peut fonctionner, les ingénieurs ont besoin de données thermodynamiques sur les états solide et liquide des alliages métalliques, en particulier, la zone de transition à laquelle un solide fond. "Nous ne sommes pas si bons sur l'état liquide, et à haute température on a aussi beaucoup de mal à mesurer l'énergie de Gibbs à l'état liquide, " dit Nakanishi.
"Ici, nous ajoutons des données expérimentales, " dit-il. " Nous avons créé une méthode qui vous permet de mesurer l'énergie libre de Gibbs d'un liquide, alors maintenant combiné avec notre capacité dans un solide, nous pouvons commencer à informer des choses comme ces températures de transition parmi d'autres questions thermodynamiques, qui sont liés à la stabilité des matériaux.
La fonte est ionique, contenant un mélange d'anions d'oxygène chargés négativement et d'atomes d'oxygène neutres ainsi que de cations d'aluminium chargés positivement et d'atomes d'aluminium neutres.
"L'importance clé des résultats de recherche de Bradley Nakanishi et Antoine Allanore est la capacité de déterminer les paramètres thermodynamiques [par exemple, activité thermodynamique] à des températures supérieures à 1, 600 C des mesures électrochimiques des oxydes fondus, ainsi que l'applicabilité à un électrolyte plus large d'un oxyde fondu à un sel fondu, " déclare Arturo Bronson, professeur de génie mécanique à l'Université du Texas à El Paso, qui n'a pas participé à cette recherche. "En outre, une relation possible de la pression partielle d'oxygène au doublement chargé, l'ion d'oxygène libre caractérisera son effet sur les cations et anions associés dans l'oxyde fondu pour expliquer le comportement thermodynamique entre le métal liquide et l'oxyde liquide."
"La qualité de la recherche est une approche de classe mondiale développée pour des études expérimentales difficiles de réactions à ultra-haute température de métaux liquides et d'oxydes liquides, en particulier avec l'inclusion de la spectroscopie d'impédance électrochimique, " dit Bronson. Cependant, une limitation de l'étude est l'incertitude des mesures de température dans une plage de plus ou moins 10 degrés C. « L'incertitude des paramètres mesurés dépendra finalement de la précision de la température mesurée [déjà à plus ou moins 10 kelvins], parce que les paramètres électrochimiques [c'est-à-dire, tension et courant] dépendra clairement de l'incertitude de température, " explique Bronson.
Plus de possibilités d'électrolyte
Allanore note que l'électrochimie est l'une des technologies de traitement les plus sélectives, « mais à ce jour, il était très difficile d'étudier l'électrochimie avec ces masses fondues à haute température. »
La sélection des électrolytes est essentielle pour concevoir de nouveaux procédés d'extraction électrochimique de métaux réactifs, et les nouveaux travaux démontrent que davantage d'électrolytes sont disponibles pour extraire les métaux. « Nous pouvons maintenant étudier la solubilité des minerais contenant des oxydes de métaux réfractaires dans ces fontes. Nous ajoutons donc essentiellement maintenant au moins trois ou quatre électrolytes candidats qui pourraient être utilisés pour l'extraction de métaux, en particulier pour ce que l'on appelle les métaux réactifs comme l'aluminium, niobium, titane, ou les terres rares, " ajoute Allanore. La recherche a été financée par l'Office of Naval Research des États-Unis.
Les travaux futurs se concentreront sur l'application de ces techniques électrochimiques à haute température pour étudier le potentiel de séparation sélective des oxydes de terres rares. Bien qu'il ne soit généralement nécessaire qu'en quantités relativement faibles, les éléments individuels des terres rares sont essentiels pour les applications de haute technologie, y compris les téléphones portables et les véhicules électriques. Des méthodes bien établies pour concentrer les oxydes de terres rares de leur minerai produisent un mélange des 14 oxydes de terres rares, Allanore note. "Si nous utilisions un mélange d'oxydes de terres rares comme électrolyte, nous pourrions potentiellement séparer sélectivement une terre rare des 13 autres, " il dit.
Nouveau, des matériaux stables tels que les oxydes de terres rares qui peuvent résister à des températures élevées sont nécessaires pour des usages aussi variés que la construction d'avions plus rapides et l'allongement de la durée de vie des centrales nucléaires. Mais un pays, Chine, détient un quasi-monopole sur la production d'éléments de terres rares. « La séparation des terres rares les unes des autres est le principal défi pour rendre l'extraction des métaux des terres rares plus durable et économiquement faisable, " dit Nakanishi.
Alors que le document récemment publié examine un électrolyte à un seul composant, l'oxyde d'aluminium seul, Nakanishi dit « notre objectif est d'étendre cette approche afin que nous puissions mesurer les potentiels chimiques, l'énergie de Gibbs, dans les électrolytes multi-composants."
« Cela ouvre la porte à de nombreux autres candidats pour les électrolytes que nous pouvons utiliser pour extraire des métaux, et aussi faire de l'oxygène, " il dit.
Cette capacité à évacuer l'oxygène en tant que sous-produit plutôt que le monoxyde de carbone ou le dioxyde de carbone a le potentiel de réduire les émissions de gaz à effet de serre et le réchauffement climatique.
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.