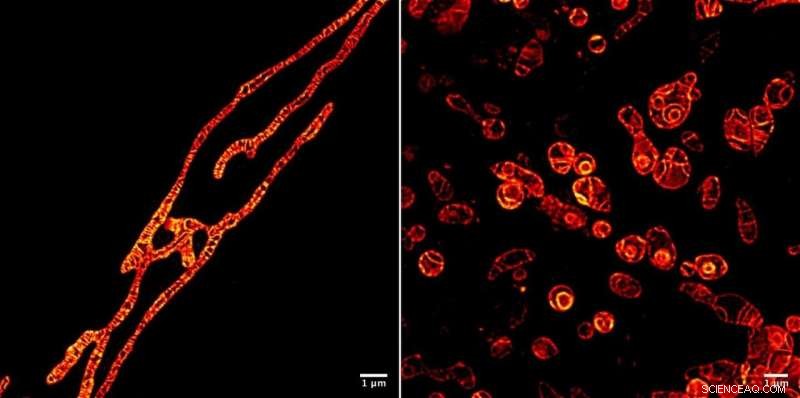
Membranes internes de mitochondries vivantes sous un microscope STED imagées à l'aide de la molécule de marqueur fluorescent MitoPB Yellow créée par des chercheurs de l'Institute of Transformative Bio-Molecules (ITbM) de l'Université de Nagoya. Les membranes externes des mitochondries sont invisibles. La molécule marqueur peut supporter le faisceau STED pendant un temps relativement long, qui permet une imagerie time-lapse du sujet vivant. La préparation des échantillons est beaucoup plus facile pour un microscope optique qu'un microscope électronique à transmission (MET), nécessitant environ une heure plutôt qu'une journée. Les cellules ne peuvent pas être imagées vivantes à l'aide de TEM. Les mitochondries ont été traitées avec un réactif qui supprime la réplication de l'ADN, induisant un dysfonctionnement, afin de voir leurs processus de survie (à gauche) et de mort (à droite). Être capable de voir les processus de dysfonctionnement se produisant à l'intérieur des mitochondries conduira à une meilleure façon de diagnostiquer la maladie mitochondriale humaine - et peut-être même à un remède. Crédit :© ITbM, Université de Nagoya
La microscopie optique est la seule façon dont nous pouvons regarder à l'intérieur d'une cellule vivante, ou des tissus vivants, en trois dimensions. Un microscope électronique ne donne qu'une vue en deux dimensions, et l'échantillon organique brûlerait rapidement en raison de la chaleur extrême du faisceau d'électrons, et ne peut donc pas être observé vivant. De plus, en marquant les biomolécules de la structure qui nous intéresse avec une molécule fluorescente spécialement conçue, on peut le distinguer de l'environnement :c'est la microscopie à fluorescence.
Jusqu'au milieu des années 1990, la microscopie à fluorescence était entravée par la physique fondamentale :en raison de la limite de diffraction, toutes les caractéristiques de l'échantillon plus proches les unes des autres qu'environ 250 nanomètres seraient floues ensemble. Les virus et les protéines individuelles sont beaucoup plus petits que cela, ils ne pouvaient donc pas être étudiés de cette façon. Mais vers 1994, dans une merveilleuse leçon nous enseignant que nous devons faire attention lorsque nous appliquons les principes physiques fondamentaux, Stefan Hell a découvert la microscopie à déplétion des émissions stimulées (STED), qui est maintenant l'une des nombreuses approches de microscopie optique qui permettent d'atteindre une "super-résolution, " résolution au-delà de la limite de diffraction. Il a reçu le prix Nobel de chimie en 2014 " pour le développement de la microscopie à fluorescence super-résolue, " avec Eric Betzig et William Moerner.
Pour voir pourquoi la limite de diffraction est un problème, imaginez que la structure d'intérêt est très petite, dire, 50 nanomètres de diamètre, comme un virus, et a été marqué avec une biomolécule fluorescente. Imaginez maintenant l'éclairer avec un spot laser, dire, 200 nanomètres de diamètre. Les molécules marqueurs illuminées émettent spontanément de la lumière, à des moments aléatoires, par fluorescence, la probabilité diminuant rapidement avec le temps. Les photons de nombreuses molécules fluorescentes sont focalisés sur un détecteur utilisant des lentilles, créant un seul pixel sans particularité. Il n'est pas entièrement brillant car seule une petite proportion de l'échantillon dans le cercle illuminé contient des molécules fluorescentes. Si vous deviez déplacer le laser de 200 nanomètres dans n'importe quelle direction, Jusqu'où, dans cet exemple, aucune molécule fluorescente n'est présente, le signal s'éteindra certainement. Donc, ce pixel plutôt faible nous indique que quelque chose est présent à l'intérieur de cette zone d'échantillon de 200 nanomètres de diamètre. La limite de diffraction nous empêche de former des pixels à partir de zones plus petites, si nous utilisons l'approche de base.
L'idée physique de la microscopie STED est très simple. Avec le spot laser éclairant à nouveau la région autour de la petite structure fluorescente, supposons que vous arrêtiez d'une manière ou d'une autre l'envoi de lumière au détecteur depuis une zone aussi large que possible à l'intérieur du spot, en laissant un spot beaucoup plus petit, dire, 60 nanomètres de diamètre. Maintenant, si vous déplacez le laser de 60 nanomètres dans n'importe quelle direction et que le signal s'éteint, le pixel dans l'image représente la présence d'une structure jusqu'à 60 nanomètres de diamètre. La limite de diffraction a été dépassée. Bien sûr, un tel pixel est sans particularité, mais une image nette des mitochondries peut être construite en balayant et en enregistrant de nombreux pixels de luminosité variable. (Voir la figure 1. "Time-gated STED Microscopy" a été utilisé pour capturer la plupart des images de cet article.)
La découverte de Stefan Hell, lauréate du prix Nobel, consiste en deux idées. D'abord, il a pensé à l'idée d'arrêter la lumière envoyée au détecteur depuis une zone aussi grande que possible à l'intérieur d'un point éclairé dont la taille correspond à la limite de diffraction. Seconde, il a compris comment y parvenir.
Deux lasers éclairent le même endroit. Le premier laser excite les électrons de la molécule marqueur et ils se désintègrent spontanément pour revenir à leur état fondamental, chacun émettant un photon visible d'une longueur d'onde spécifique. (C'est la fluorescence.) Le processus est aléatoire, la probabilité d'émission diminuant assez rapidement avec le temps, ce qui signifie que la plupart des photons sont émis dans les premières nanosecondes suivant l'illumination de l'échantillon. Un deuxième laser, le "poutre STED, " façonné avec un trou au milieu pour ne pas y affecter les molécules marqueurs, est réglé pour stimuler l'émission d'un photon par la molécule de marqueur excitée dans l'anneau externe. Mais comment ces photons se distinguent-ils des photons émis par le milieu ?
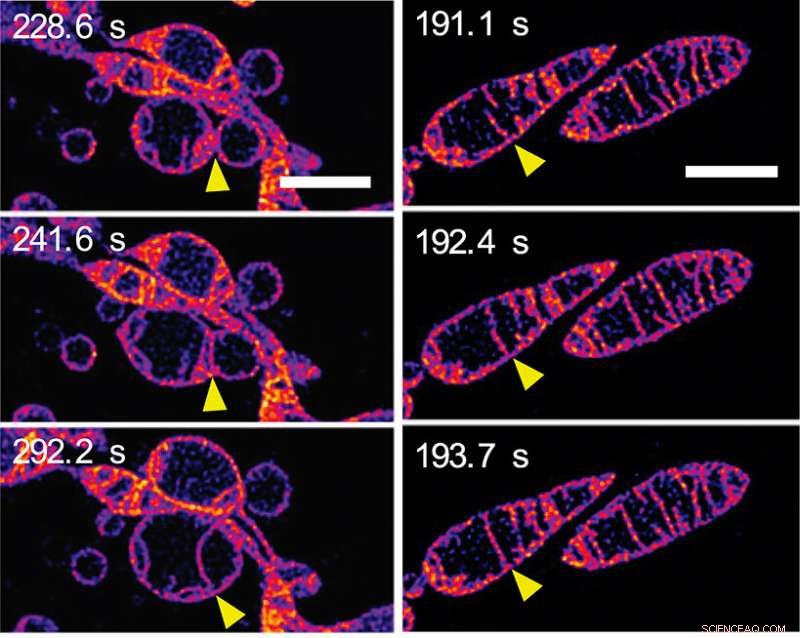
En réponse à la privation de nutriments, les mitochondries fusionnent et augmentent le nombre de crêtes. (a) Images d'une séquence accélérée montrant deux mitochondries distinctes fusionnant pour former une seule mitochondrie. Les membranes externes des mitochondries sont invisibles :nous voyons les membranes internes fusionner. (b) Images d'une séquence accélérée montrant deux crêtes à l'intérieur d'une seule mitochondrie fusionnant ensemble. (Voir la vidéo 2 dans le matériel supplémentaire sur la page Web PNAS de l'article.) Les barres d'échelle représentent 2 mm. Crédit :© ITbM, Université de Nagoya
Le processus d'émission de l'anneau extérieur est également aléatoire mais se produit beaucoup plus rapidement, la probabilité diminue rapidement, ce qui signifie que la plupart de ces photons sont émis en une nanoseconde environ. Lorsque les deux faisceaux superposés balayent l'échantillon, au moment où le centre de l'anneau devient fluorescent, les molécules environnantes ont déjà été forcées dans leur état fondamental en émettant un photon - elles ont été « éteintes ». La technique de microscopie STED repose sur un timing intelligent de cette manière. En principe, la taille du point central lumineux peut être aussi petite que vous le souhaitez, donc n'importe quelle résolution est possible. Cependant, le "faisceau STED" en forme de beigne fournirait alors de l'énergie sous forme de lumière laser visible concentrée à une plus grande surface de la cellule vivante, risquer de le tuer.
Néanmoins, le processus n'est pas idéal, et l'image résultante perd un peu de netteté parce que certaines molécules marqueurs dans l'anneau extérieur ne sont pas correctement éteintes - le processus est probabiliste, après tout, et quand ils sont fluorescents, ils contaminent le signal du centre. Cependant, en raison de la synchronisation différente de l'émission spontanée et stimulée, les premiers photons à arriver au détecteur proviennent de régions illuminées par l'intensité de faisceau STED la plus élevée, et les derniers photons à arriver proviennent très probablement de molécules marqueurs situées dans la tache centrale. Donc en attendant un peu (environ une nanoseconde) avant d'enregistrer l'image, la plupart des photons de l'anneau externe peuvent être filtrés. C'est ce qu'on appelle la "microscopie STED temporisée". Une netteté supplémentaire de l'image est obtenue grâce à un processus appelé déconvolution.
L'invention de la microscopie à super-résolution a marqué un bond en avant dans les sciences de la vie. Les organismes vivants ont pu être observés à une résolution sans précédent. Cependant, les séquences d'images en accéléré n'ont pas pu être réalisées sur une durée décente car les molécules marqueurs se dégraderaient sous le faisceau STED intense et cesseraient de devenir fluorescentes. C'est le problème du photoblanchiment. Les molécules marqueurs endommagées peuvent également devenir toxiques pour la cellule.
Le problème du photoblanchiment résolu
Shigehiro Yamaguchi et Masayasu Taki, de l'Institut des biomolécules transformatrices de l'Université de Nagoya (ITbM), a dirigé une équipe de recherche qui a développé une molécule marqueur, appelé « MitoPB Jaune, " qui est absorbé par la membrane interne des mitochondries, y compris les crêtes - les structures en forme de pli - et a une longue durée de vie sous un faisceau STED. L'idée de la molécule marqueur ciblant les mitochondries est venue du co-auteur Chenguang Wang, de l'ITBM. L'imagerie STED multicolore avec un seul laser STED est également possible; et les chercheurs s'attendent à ce que des marqueurs fluorescents similaires à MitoPB Yellow trouvent également un large éventail d'applications dans d'autres techniques de super-résolution (comme celles développées par Eric Betzig et William Moerner).
Pour démontrer l'utilité pratique de MitoPB Yellow pour l'imagerie des cellules vivantes, le groupe a placé les mitochondries dans des conditions connues pour provoquer certains changements structurels - mais jusqu'à présent, ceux-ci n'ont été observés qu'en microscopie électronique à transmission, qui ne peut pas être utilisé sur des cellules vivantes. Les mitochondries ont été traitées avec un réactif qui supprime la réplication de l'ADN, induisant un dysfonctionnement, afin d'observer leurs processus de survie et de mort.