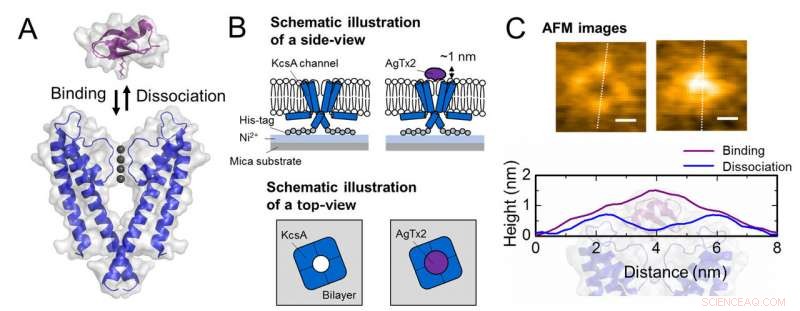
Schéma d'association et de dissociation des canaux potassiques KcsA (Q58A/T61S/R64D) et AgTx2 et images AFM représentatives. A. Association (contraignante) de KcsA et AgTx2. B. Schéma montrant un spécimen pour l'observation AFM.
C. Images AFM représentatives et dimensions indiquées sous forme de lignes pointillées blanches. Bar, 2 nm. Crédit :Université de Kanazawa
L'agitoxine-2 (AgTx2) du venin de scorpion est un puissant bloqueur des canaux K+. Les chercheurs ont maintenant observé la dynamique de liaison d'AgTx2 au canal KcsA en utilisant la microscopie à force atomique à grande vitesse. Des analyses cinétiques de molécules uniques ont révélé que l'affinité du canal pour AgTx2 augmentait pendant la liaison persistante et diminuait pendant la dissociation persistante. Les chercheurs proposent un modèle à quatre états avec des constantes de vitesse pertinentes. Une voie d'ajustement induit était dominante et accélérait la liaison de 400 fois.
Les membranes cellulaires contiennent des canaux ioniques qui régulent la perméation de divers ions entre l'intérieur et l'extérieur de la cellule. Les canaux ioniques sont des protéines, et en réponse à divers stimuli, ils permettent à des ions spécifiques de pénétrer. De cette façon, la cellule régule les signaux électriques qui constituent la base du fonctionnement des muscles et du système nerveux. Étant donné qu'un dysfonctionnement des canaux ioniques provoque un certain nombre de troubles tels que l'infarctus du myocarde et l'épilepsie, il est important de comprendre le mécanisme d'action des molécules qui entravent les fonctions des canaux ioniques.
Il a été découvert que le venin de scorpion contient plus de 200 composés qui se lient aux canaux K+. Parmi eux, AgTx2 est un peptide constitué de 38 résidus d'acides aminés. Des études antérieures ont montré qu'en se liant au canal K+ depuis l'extérieur de la membrane cellulaire, AgTx2 bloque le pore du canal K+ et inhibe la perméation du K+. Cependant, le mécanisme moléculaire détaillé est resté inconnu, par exemple. si la dynamique de liaison pourrait être expliquée par un modèle d'association et de dissociation à deux états.
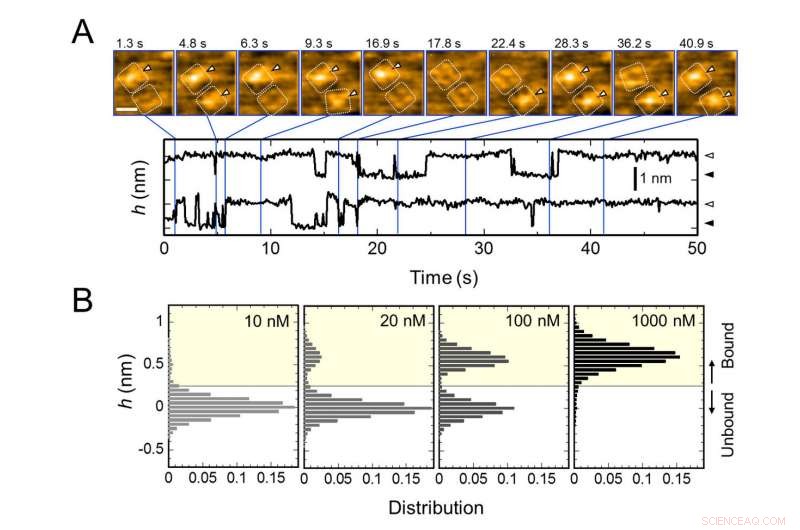
Liaison répétitive d'AgTx2 aux canaux potassiques KcsA et AgTx2 - dépendance à la concentration de la probabilité de liaison. A. Images en accéléré de la liaison AgTx2 et de la dissociation des canaux KcsA et des cours dans le temps de la hauteur moyenne (h) (nm) autour du centre de la surface extracellulaire. Barre d'échelle dans l'image HS-AFM, 5 nm. B. Histogrammes de hauteur de h en fonction de la concentration d'AgTx2 dans la solution. Crédit :Université de Kanazawa
L'équipe de recherche, y compris des scientifiques de l'Université de Kanazawa, visualisé l'association et la dissociation de AgTx2 avec le canal K + KcsA en utilisant la microscopie à force atomique à grande vitesse (HS-AFM) et a effectué une analyse détaillée de la dynamique (Figure 1). KcsA est un tétramère, ses sous-unités formant une structure annulaire. Lors de la liaison d'AgTx2 à la surface du tétramère, la partie centrale du canal, c'est-à-dire le passage pour K+, semblait gonflé en raison de la liaison AgTx2. La liaison et la dissociation d'AgTx2 au canal K+ pourraient avoir lieu à plusieurs reprises et la hauteur autour du centre du canal a changé en conséquence (Figure 2).
Lorsque la concentration d'AgTx2 dans la solution était élevée, la probabilité de liaison était également élevée. Les cours dans le temps de la liaison et de la dissociation ont révélé que lors de la liaison d'AgTx2 à KcsA, la conformation de KcsA a changé, ce qui a permis à AgTx2 de lier plus facilement, et que même lors de la dissociation de AgTx2, une autre molécule AgTx2 pourrait se lier très rapidement à KcsA; c'est ce qu'on appelle un mécanisme d'ajustement induit. D'autre part, il a été observé que, lorsqu'un temps suffisant s'est écoulé après la dissociation d'AgTx2, la conformation de KcsA est revenue à l'original, auquel AgTx2 se liait moins facilement.
Ces résultats indiquent que la dynamique de liaison ne peut pas être expliquée avec un simple modèle à deux états, c'est-à-dire la liaison et la dissociation. Il semblait que les états d'association et de dissociation de KcsA pouvaient être distingués comme au moins deux sous-états; un modèle d'association à quatre états a donc été envisagé (Figure 3). Lorsque les vitesses de réaction ont été calculées pour un modèle à quatre états, les vitesses obtenues reflétaient celles obtenues expérimentalement. Une simulation de la dynamique de liaison avec ce modèle à quatre états et les vitesses de réaction associées, ont montré que la liaison d'AgTx2 se faisait principalement via la voie d'ajustement induit. Plus loin, il a été constaté que l'ajustement induit accélérait la liaison d'AgTx2 de 400 fois. Ainsi, le mécanisme d'AgTx2 pour inhiber efficacement la fonction de KcsA a été élucidé (Figure 3).
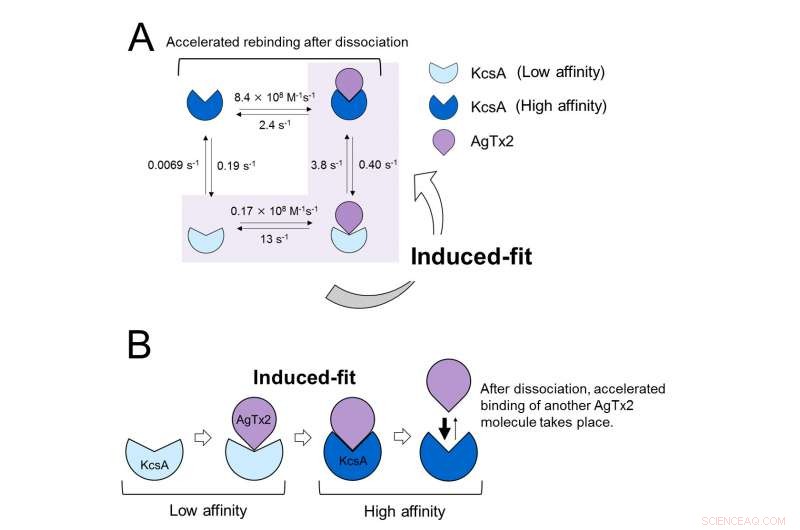
Modèle de dynamique de liaison d'AgTx2 et du canal potassique KcsA. A. Constantes de vitesse des étapes de réaction. B. Liaison accélérée d'AgTx2 au canal potassique KcsA par le biais d'un mécanisme d'ajustement induit. Crédit :Université de Kanazawa
La technique et la méthode d'observation HS-AFM utilisées pour l'analyse de la liaison du canal K+ et de l'inhibiteur peptidique peuvent être appliquées à une grande variété de molécules biologiques. Ils peuvent être appliqués aux analyses d'un ligand se liant à son récepteur ainsi qu'à l'association d'ADN et d'une protéine se liant à l'ADN. Cette étude devrait accélérer l'élucidation de la dynamique de liaison de diverses molécules biologiques.
L'étude est publiée dans Avancées scientifiques .