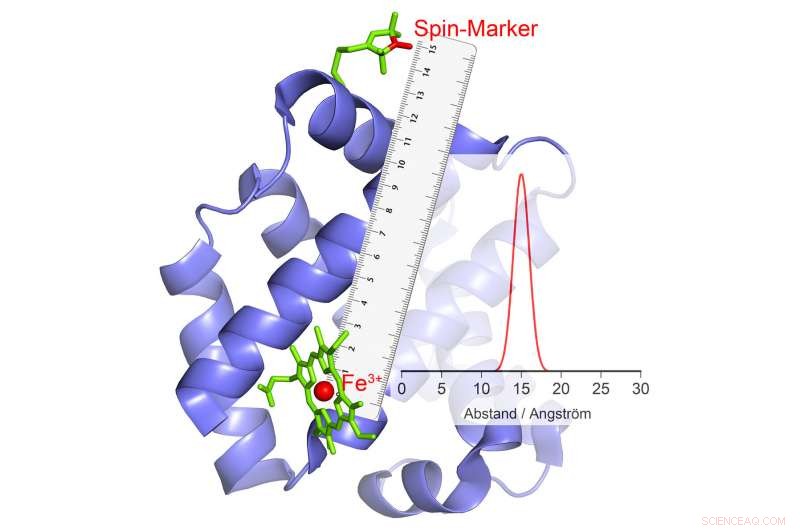
S'il change de polarité, cela provoque un écho dans le marqueur magnétique, à partir de laquelle la distance peut être calculée. Crédit :© AG Schiemann/Uni Bonn
Des scientifiques de l'Université de Bonn ont mis au point une méthode permettant de "photographier" une enzyme à l'œuvre. Leur méthode permet de mieux comprendre la fonction de biomolécules importantes. Les chercheurs espèrent également mieux comprendre les causes de certains troubles enzymatiques. L'étude sera publiée dans la revue Chimie – Une revue européenne .
Si un extraterrestre a vu une photo d'une paire de ciseaux pour la première fois dans un catalogue de fournitures d'artisanat, il n'aurait probablement aucune idée de ce à quoi nous, les terriens, utilisons cette chose. Si, d'autre part, on lui montrait une vidéo dans laquelle les ciseaux s'ouvrent et se ferment, il pourrait peut-être déduire leur fonction avec un peu d'imagination.
Les scientifiques ont une approche très similaire lorsqu'ils veulent comprendre comment fonctionne une enzyme :s'ils connaissent la structure de la molécule, puis généralement uniquement sous forme d'image fixe. Ils ne savent pas comment l'enzyme se comporte en action, quelles parties se rapprochent et quelles parties s'éloignent les unes des autres.
Les enzymes catalysent certaines réactions chimiques dans les cellules, comparable aux ciseaux qui coupent le papier. Ils ont des centres catalytiques (les lames) qui entrent en contact avec la matière première (le papier). "La forme tridimensionnelle de l'enzyme change généralement au cours de ce processus, " explique le professeur Olav Schiemann de l'Institut de chimie physique et théorique de l'Université de Bonn. " Normalement, ces changements de conformation ne peuvent pas être rendus visibles, ou seulement avec beaucoup d'efforts. Cela rend souvent difficile la compréhension du mécanisme de catalyse. »
Le groupe de recherche de Schiemann a réussi à développer une méthode avec laquelle les mouvements de parties de la protéine les unes par rapport aux autres peuvent être mesurés au cours de la catalyse. Les scientifiques de Bonn travaillent sur de telles méthodes avec grand succès depuis plusieurs années maintenant. Dans leur étude actuelle, ils ont examiné un groupe particulièrement important d'enzymes. Ceux-ci portent des ions métalliques avec de nombreux électrons non appariés dans leurs centres catalytiques. Un exemple est l'hémoglobine, qui lie l'oxygène à l'aide d'un ion fer et peut ainsi être transporté dans le sang.
Retourner les ions
"Nos méthodes actuelles sont inadaptées à de tels ions à spin élevé, " explique le collègue de Schiemann, le Dr Dinar Abdullin. " Nous avons donc développé une nouvelle méthode, a élaboré la théorie et l'a testée avec succès. » Les chercheurs ont utilisé le fait que les ions à spin élevé se comportent comme de petits électro-aimants. De plus, ils peuvent changer de polarité au hasard — ils « basculent » :le pôle Nord devient le pôle Sud et le pôle Sud devient le pôle Nord.
Ce phénomène peut être utilisé pour la mesure de distance. Ici, les scientifiques associent l'enzyme à certains composés chimiques qui ont également des propriétés électromagnétiques. "Quand les ions à spin élevé basculent, ces petits électro-aimants réagissent au champ magnétique modifié dans leur environnement en changeant également leur polarité, " explique Abdullin. Quand et comment ils le font dépend, entre autres, sur la distance à l'ion à spin élevé. Cela permet de déterminer la distance entre les deux avec une telle précision.
Si plusieurs groupes magnétiques sont liés à une enzyme, on obtient la distance de chacun de ces groupes à l'ion à spin élevé et donc au centre catalytique. « En combinant ces valeurs, on peut mesurer la position spatiale de ce centre, comme si nous utilisions un GPS moléculaire, " explique Schiemann. " Par exemple, nous pouvons déterminer comment sa position change par rapport aux autres groupes magnétiques au cours de la catalyse."
Cependant, les scientifiques ne sont pas encore capables de vraiment observer l'enzyme à l'œuvre. "Nous travaillons toujours avec des cellules congelées, " dit Schiemann. " Ceux-ci contiennent de nombreuses enzymes qui ont été congelées à différents moments au cours de la réaction catalytique. On n'obtient donc pas de film, mais une série d'"images fixes - comme si les ciseaux de l'exemple d'introduction étaient photographiés à d'innombrables moments différents au cours du processus de montage.
"Mais nous travaillons déjà sur la prochaine amélioration, » souligne le chimiste :« La mesure spatiale des biomolécules dans les cellules et à température ambiante. » Les chercheurs espèrent ainsi mieux comprendre le développement de certaines maladies qui sont déclenchées par des troubles fonctionnels des enzymes.