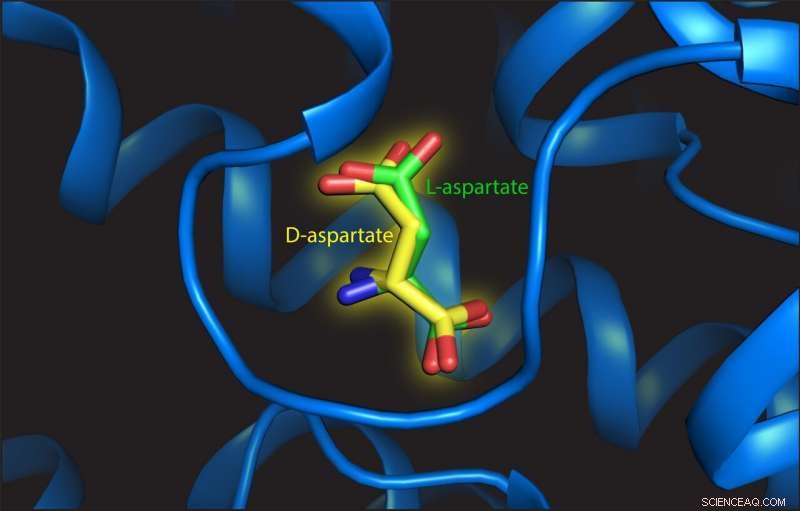
Cette illustration montre L- et D-aspartate sur le site de liaison de la protéine de transport. Crédit :Valentina Arkhipova, Université de Groningue
De nombreuses biomolécules se déclinent en deux versions qui sont l'image miroir l'une de l'autre, comme une main gauche et une main droite. Les cellules utilisent généralement la version gauche des acides aminés pour produire des protéines, et les mécanismes d'adoption ont été pensés pour partager cette préférence. Des scientifiques de l'Université de Groningue ont maintenant montré qu'une protéine de transport procaryote peut transporter les deux versions de l'acide aminé aspartate avec une efficacité égale. Une analyse détaillée de la structure du transporteur montre pourquoi c'est le cas. Les résultats ont été publiés dans la revue eLife le 24 avril.
La 'liberté' de la vie est connue depuis plus d'un siècle. De nombreuses molécules organiques sont produites en deux versions qui ont la même formule chimique et la même connectivité entre les atomes mais sont structurellement l'image miroir de l'autre. Au cours de l'évolution, la version gaucher (L) a été retenue pour certaines molécules, alors que pour d'autres l'image miroir (D) est utilisée. C'est un problème dans la fabrication de médicaments, où parfois une seule version est efficace et l'autre version peut provoquer des effets secondaires graves.
Contre les attentes
"Les organismes vivants utilisent des acides L-aminés dans la production de protéines, mais ils utiliseront occasionnellement des acides aminés D, par exemple dans les parois cellulaires bactériennes, " explique Dirk Slotboom, professeur de biochimie à l'Université de Groningue. Le système nerveux central des mammifères possède une protéine de transport pour le neurotransmetteur L-glutamate qui peut également transporter l'acide aminé aspartate. " Et cela s'avère reconnaître à la fois le L-aspartate et le D- aspartate."
Cela va à l'encontre des attentes. Puisque les acides L-aminés sont les composés fonctionnellement actifs, il serait logique que les protéines de transport ne sélectionnent qu'une seule "main". Slotboom : « Cela découle de la différence de structure. La reconnaissance par un transporteur nécessite que la structure de la molécule s'adapte au site de liaison. » Et de même qu'il n'est pas possible de mettre la main gauche dans un gant pour droitier, la liaison des acides aminés D à une protéine de transport qui a évolué pour accepter les acides aminés L est impossible.
Affinité
Aucune véritable étude mécanistique ou structurale n'a été menée jusqu'à présent pour expliquer pourquoi le transporteur du système nerveux central semble défier cette logique. Donc Slotboom, avec son collègue Albert Guskov, Professeur assistant et responsable du laboratoire de cristallographie aux rayons X biomoléculaires, décidé d'aborder cette question. Leur chercheuse postdoctorale Valentina Arkhipova a réalisé une analyse structurale de la protéine de transport, tandis que le doctorat l'étudiant Gianluca Trinco a réalisé des études fonctionnelles. Pour leurs expériences, ils ont utilisé la protéine de transport homologue trouvée dans les micro-organismes, qui a un site de liaison presque identique à celui du transporteur mammifère.
Trinco a découvert que le L-aspartate et le D-aspartate étaient transportés de la même manière, alimenté par la translocation de trois ions sodium. "En outre, l'affinité pour les deux substrats est également similaire, " dit-il. Arkhipova a étudié la structure du site de liaison avec du L- ou du D-aspartate attaché. Elle a observé que le D-aspartate était logé avec seulement des réarrangements mineurs de la structure:"La clé est qu'il y ait suffisamment d'espace pour le D-aspartate différent à lier. Le site de liaison n'est pas comme un gant, mais plutôt comme une mitaine."
Neurotransmetteur
Chez les micro-organismes, la protéine ne transporte que l'aspartate, que les cellules pourraient utiliser pour construire des protéines et également utiliser comme carburant ou comme source d'azote. Chez les mammifères, la protéine homologue transporte le glutamate dans le système nerveux central, où l'acide aminé est utilisé comme neurotransmetteur. La protéine de transport élimine le L-glutamate de la fente synaptique, la partie où une impulsion nerveuse est transmise à un autre neurone.
Il existe des indications que l'aspartate peut également agir comme un neurotransmetteur. « Si tel était le cas, le L- et le D-aspartate pourraient remplir cette fonction, " dit Slotboom. " L'affinité pour les deux types d'aspartate est très élevée. Cela peut indiquer une fonction spécifique et suggère que le D-aspartate est également utilisé pour quelque chose. » Fait intéressant, Le D-glutamate n'est pas accepté par le transporteur. De nouveau, cela semble être une question d'espace :le glutamate a un groupe méthylène supplémentaire par rapport à l'aspartate. "Et en D-glutamate, que le méthylène provoque probablement un conflit avec le site de liaison. même pas en moufle.