La mélatonine, une hormone favorisant le sommeil (représentée sous la forme d'une constellation dans le ciel nocturne) est synthétisée à partir de la sérotonine (représentée sous la forme d'un cerf-volant) pendant la nuit, et ces deux molécules archaïques sont antérieures à l'évolution animale. Des niveaux élevés de mélatonine la nuit lui permettent d'établir ses propriétés favorisant le sommeil en agissant par l'intermédiaire de récepteurs de haute affinité, représenté dans la partie droite de la composition de l'image. Crédit :Yekaterina Kadyshevskaya, Bridge Institute au USC Michelson Center for Convergent Bioscience.
Une équipe internationale de chercheurs a utilisé un laser à rayons X au Laboratoire national de l'accélérateur SLAC du ministère de l'Énergie pour créer les premières cartes détaillées de deux récepteurs de la mélatonine qui indiquent à notre corps quand s'endormir ou se réveiller et guider d'autres processus biologiques. Une meilleure compréhension de leur fonctionnement pourrait permettre aux chercheurs de concevoir de meilleurs médicaments pour lutter contre les troubles du sommeil, cancer et diabète de type 2. Leurs conclusions ont été publiées aujourd'hui dans deux articles en La nature .
L'équipe, dirigé par l'Université de Californie du Sud, utilisé les rayons X de la source de lumière cohérente Linac (LCLS) du SLAC pour cartographier les récepteurs, MT1 et MT2, lié à quatre composés différents qui activent les récepteurs :un médicament contre l'insomnie, un médicament qui mélange la mélatonine avec l'antidépresseur sérotonine, et deux analogues de la mélatonine.
Ils ont découvert que les deux récepteurs de la mélatonine contiennent des canaux étroits intégrés dans les membranes graisseuses des cellules de notre corps. Ces canaux ne laissent passer que la mélatonine, qui peut exister à la fois dans l'eau et dans la graisse, bloquer la sérotonine, qui a une structure similaire mais n'est heureux que dans les environnements aqueux. Ils ont également découvert comment certains composés beaucoup plus gros peuvent cibler uniquement MT1 et non MT2, malgré les similitudes structurelles entre les deux récepteurs. Cela devrait éclairer la conception de médicaments qui ciblent sélectivement MT1, ce qui jusqu'à présent a été difficile.
"Ces récepteurs remplissent des fonctions extrêmement importantes dans le corps humain et sont des cibles médicamenteuses majeures d'un grand intérêt pour l'industrie pharmaceutique, " a déclaré Linda Johansson, un chercheur postdoctoral à l'USC qui a dirigé les travaux structurels sur MT2. "Grâce à ce travail, nous avons pu obtenir une compréhension très détaillée de la façon dont la mélatonine est capable de se lier à ces récepteurs."
L'heure d'aller se coucher
Les gens le font, les oiseaux le font, les poissons le font. Presque tous les êtres vivants du règne animal dorment, et pour une bonne raison.
"Il est essentiel que le cerveau se repose et traite et stocke les souvenirs que nous avons accumulés au cours de la journée, " a déclaré le co-auteur Alex Batyuk, un scientifique au SLAC. "La mélatonine est l'hormone qui régule nos cycles veille-sommeil. Quand il y a de la lumière, la production de mélatonine est inhibée, mais quand l'obscurité arrive, c'est le signal pour que notre cerveau s'endorme."
Les récepteurs de la mélatonine appartiennent à un groupe de récepteurs membranaires appelés récepteurs couplés aux protéines G (RCPG) qui régulent presque tous les processus physiologiques et sensoriels du corps humain. MT1 et MT2 se trouvent dans de nombreux endroits du corps, y compris le cerveau, rétine, système cardiovasculaire, le foie, un rein, rate et intestin..
Ces récepteurs supervisent nos gènes d'horloge, les chronométreurs de l'horloge interne du corps, ou rythme circadien. Dans un monde parfait, nos horloges internes se synchroniseraient avec le lever et le coucher du soleil. Mais quand les gens voyagent à travers les fuseaux horaires, travailler des quarts de nuit ou passer trop de temps devant des écrans ou d'autres sources artificielles de lumière bleue, ces chronométreurs sont détraqués.
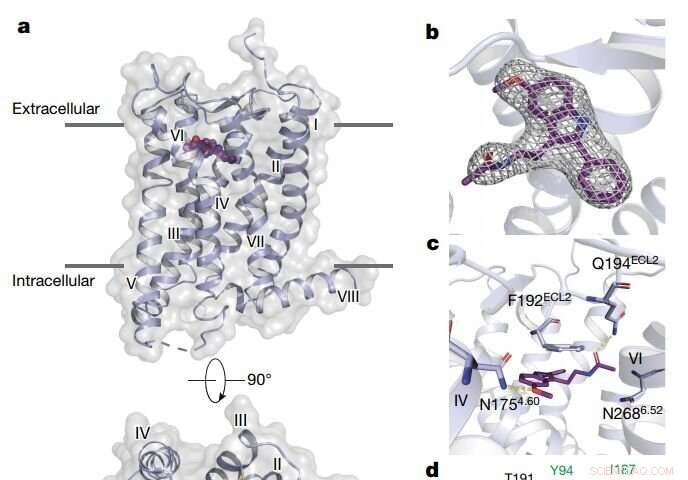
Vue d'ensemble de la structure MT2. Crédit: La nature (2019). DOI :10.1038/s41586-019-1144-0
Contrôler le rythme
Lorsque nos rythmes circadiens sont perturbés, cela peut conduire à la psychiatrie, métabolique, oncologiques et de nombreuses autres conditions. MT1 en particulier joue un rôle important dans le contrôle de ces rythmes, mais la conception de médicaments capables de cibler sélectivement ce récepteur s'est avérée difficile. De nombreuses personnes prennent des suppléments de mélatonine en vente libre pour lutter contre les problèmes de sommeil ou modifier leurs rythmes circadiens, mais les effets de ces médicaments s'estompent souvent en quelques heures.
En déchiffrant les plans de ces récepteurs et en cartographiant comment les ligands s'y lient et les activent, les chercheurs ont ouvert la voie à d'autres pour concevoir des médicaments plus sûrs, plus efficace et capable de cibler sélectivement chaque récepteur.
« Depuis la découverte de la mélatonine il y a 60 ans, il y a eu de nombreuses découvertes marquantes qui ont conduit à ce moment, " a déclaré Margarita L. Dubocovich, un éminent professeur SUNY de pharmacologie et de toxicologie à l'Université de Buffalo qui a été le pionnier de l'identification des récepteurs fonctionnels de la mélatonine au début des années 80 et a fourni un point de vue extérieur sur cette recherche. « Malgré des progrès remarquables, la découverte de médicaments MT1 sélectifs est restée insaisissable pour mon équipe et les chercheurs du monde entier. L'élucidation des structures cristallines des récepteurs MT1 et MT2 ouvre un nouveau chapitre passionnant pour le développement de médicaments pour traiter les troubles du sommeil ou du rythme circadien connus pour causer des troubles psychiatriques, métabolique, oncologiques et de nombreuses autres affections."
Récolte des cristaux
Pour cartographier des biomolécules comme des protéines, les chercheurs utilisent souvent une méthode appelée cristallographie aux rayons X, en diffusant les rayons X des versions cristallisées de ces protéines et en utilisant les motifs que cela crée pour obtenir une structure tridimensionnelle. Jusqu'à maintenant, le défi avec la cartographie MT1, MT2 et des récepteurs similaires était à quel point il était difficile de faire croître des cristaux suffisamment gros pour obtenir des structures à haute résolution.
"Avec ces récepteurs de la mélatonine, nous avons vraiment dû faire un effort supplémentaire, " dit Benjamin Stauch, qui a dirigé le gros œuvre du MT1. "Beaucoup de gens avaient essayé de les cristalliser sans succès, nous avons donc dû être un peu inventifs."
Un élément clé de cette recherche était la méthode unique utilisée par les chercheurs pour faire croître leurs cristaux et collecter des données de diffraction des rayons X à partir d'eux. Pour cette recherche, l'équipe a exprimé ces récepteurs dans des cellules d'insectes et les a extraits à l'aide de détergent. Ils ont muté ces récepteurs pour les stabiliser, permettant la cristallisation. Après avoir purifié les récepteurs, ils les ont placés dans un gel semblable à une membrane, qui soutient la croissance cristalline directement à partir de l'environnement membranaire. Après obtention de microcristaux en suspension dans ce gel, ils ont utilisé un injecteur spécial pour créer un flux étroit de cristaux qu'ils ont zappé avec les rayons X de LCLS.
"En raison de la petite taille du cristal, ce travail ne pouvait se faire qu'au LCLS, " a déclaré Vadim Cherezov, un professeur de l'USC qui a supervisé les deux études. "De tels petits cristaux ne se diffractent pas bien aux sources synchrotron car ils souffrent rapidement de dommages causés par les rayonnements. Les lasers à rayons X peuvent surmonter le problème des dommages causés par les rayonnements grâce au principe" diffraction-avant-destruction "."
Les chercheurs ont collecté des centaines de milliers d'images des rayons X diffusés pour comprendre la structure tridimensionnelle de ces récepteurs. Ils ont également testé les effets de dizaines de mutations pour approfondir leur compréhension du fonctionnement des récepteurs.
En plus de découvrir de minuscules, les canaux de mélatonine dans les récepteurs, les chercheurs ont pu cartographier les mutations associées au diabète de type 2 sur le récepteur MT2, pour la première fois de voir l'emplacement exact de ces mutations dans le récepteur.
Jeter les bases
Dans ces expériences, les chercheurs n'ont examiné que les composés qui activent les récepteurs, appelés agonistes. À suivre, ils espèrent cartographier les récepteurs liés aux antagonistes, qui bloquent les récepteurs. Ils espèrent également utiliser leurs techniques pour étudier d'autres récepteurs GPCR dans le corps.
"En tant que biologiste structuraliste, c'était passionnant de voir la structure de ces récepteurs pour la première fois et de les analyser pour comprendre comment ces récepteurs reconnaissent sélectivement leurs molécules de signalisation, " Cherezov a déclaré. "Nous les connaissons depuis des décennies, mais jusqu'à présent, personne ne pouvait dire à quoi ils ressemblaient réellement. Maintenant, nous pouvons les analyser pour comprendre comment ils reconnaissent des molécules spécifiques, qui, nous l'espérons, jette les bases d'un meilleur, médicaments plus efficaces."