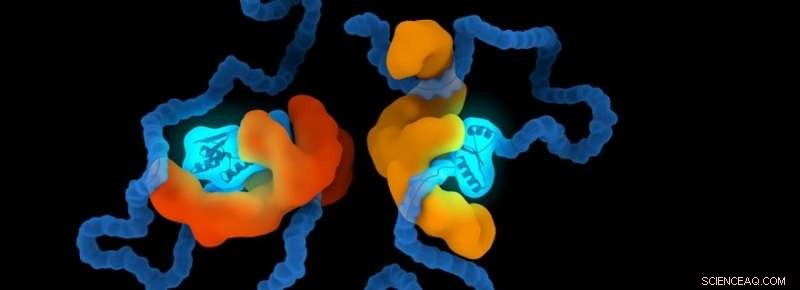
Crédit :Université de Leyde
Les chaperons sont un ensemble de protéines spécialisées pour aider les protéines dans le corps humain. Ils aident les protéines à se plier à la bonne forme et les protègent contre l'adaptation de mauvaises formes. Le groupe de recherche d'Alireza Mashaghi, professeur assistant et chercheur principal au LACDR, étudie ces structures. Vahid Satarifard, étudiant diplômé du groupe de recherche :« Plus de cinquante maladies ont été identifiées comme étant associées à un mauvais repliement des protéines. Beaucoup d'entre elles sont très dévastatrices et de plus en plus répandues. Dans les maladies protéopathiques, les protéines peuvent se replier dans le mauvais sens, devenir structurellement anormal. Cela les amène à devenir toxiques ou à perdre leur fonction normale.
On ne comprend pas bien comment les chaperons aident d'autres molécules. Il a été suggéré que les chaperons se lient aux protéines et que cela guide leur repliement. Mashaghi : « Les chaperons sont connus pour imposer une contrainte sur leurs protéines clientes, mais la question de savoir si ces contraintes ont des implications sur le repliement des protéines est ouverte. Nous avons montré que ces confinements peuvent effectivement affecter le processus de pliage. Certaines formes sont moins occupées tandis que d'autres sont formées avec une probabilité accrue. Nous avons identifié des règles qui régissent ce processus. Ces règles montrent la probabilité qu'une protéine adopte une certaine forme sous une contrainte donnée.
Traiter les formes
Mashaghi : « Nous avons demandé si nous pouvions définir la topologie d'une molécule linéaire telle qu'une protéine ou de l'ADN. La topologie traite des formes. Une idée centrale dans ce domaine est que si vous prenez un objet et le déformez continuellement, les caractéristiques topologiques ne changent pas, mais une déformation discontinue telle que la rupture d'un objet change sa topologie."
Mashaghi a une formation en biophysique. "Tirer deux extrémités de diverses protéines et morceaux d'ADN ressemble beaucoup à tirer sur une corde. Pour les cordes, la théorie des nœuds sert de cadre standard pour définir les formes. Ce que nous et d'autres chercheurs avons réalisé, c'est que plus de 97% de nos protéines ne forment pas de nœud lorsque vous tirez dessus et tombent ainsi dans une classe de forme, à savoir le "dénoué". Nous nous sommes demandé si nous pouvions définir la topologie pour ces 97 pour cent des protéines et donc être en mesure de les catégoriser en fonction de leurs formes. "
D'abord, l'équipe de recherche a simulé une chaîne polymère confinée à l'intérieur d'une sphère. Puis, ils ont étudié comment cette retenue peut affecter la structure. Satarifard :"Dans cette étude, nous avons utilisé des modèles polymères bien établis avec un nouveau cadre, se concentrer sur la forme plutôt que sur la taille et les distances. Ce cadre peut donner une nouvelle vision de la structure basée sur l'arrangement des contacts. Nous supposons que dans les biopolymères des circuits similaires existent, ce qui serait assez flexible sous certaines conditions."
Simuler une biomolécule
L'équipe de recherche a également comparé les formes d'une chaîne sans contrainte avec le moment où elle est contrainte extérieurement ou intérieurement par une autre molécule. Maziar Heidari, l'un des étudiants diplômés, déclare :"Ceci est important en biologie parce que la fonctionnalité d'une biomolécule est largement déterminée par sa forme. Par exemple, la façon dont une protéine est repliée et cache ses sites de liaison peut affecter ses fonctionnalités et ses interactions avec les autres protéines."
L'équipe de recherche a observé que la forme interne et l'organisation du pliage changent considérablement à mesure que la chaîne subit différents niveaux de confinement. Heidari :« C'est intéressant car cela met en lumière la fonctionnalité et la dynamique des mécanismes et voies possibles par lesquels une molécule externe telle qu'un chaperon se replie et confine ses molécules clientes. De plus, nos résultats ne se limitent pas à l'étude des molécules biologiques existantes. Nos découvertes peuvent inspirer d'autres scientifiques à concevoir une molécule artificielle ou un médicament qui cible les processus de repliement des protéines ou du génome."