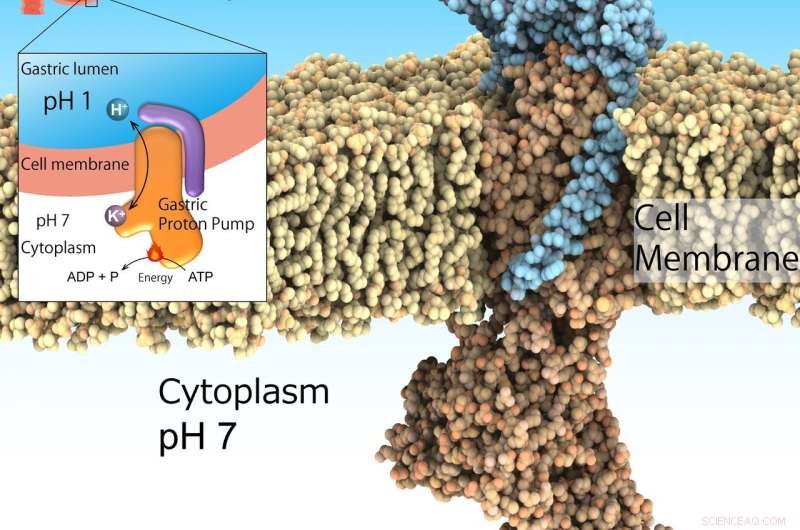
La pompe gastrique à protons, également appelé H+, K+-ATPase, s'exprime à la surface de l'estomac pour sécréter l'acide gastrique indispensable à la digestion des protéines des aliments. Cependant, trop de sécrétion acide provoque des ulcères. La pompe à protons gastrique absorbe les protons du cytoplasme neutre (pH 7) vers le milieu acide de l'estomac (pH 1) entraîné par l'ATP comme source d'énergie. Ainsi, c'est une cible médicamenteuse importante pour les maladies liées à l'acidité. Crédit :Kazuhiro Abe
L'environnement très acide de l'estomac est essentiel à la digestion. Par ailleurs, il agit comme une barrière importante contre les agents pathogènes invasifs. Cependant, une acidification excessive de l'estomac entraîne des ulcères. Bien qu'il ne s'agisse pas d'une maladie mortelle, il peut considérablement nuire à la santé des personnes touchées. La suppression acide en association avec des antibiotiques est le traitement reconnu pour éradiquer la bactérie Helicobacter pylori, un facteur de risque de cancer gastrique. Cet environnement de pH1 est régulé par le H gastrique + , K + -ATPase, une classe d'enzymes qui catalysent H + transport de la solution cytosolique neutre (pH 7) à la lumière gastrique acide (pH 1) alimentée par la source d'énergie cellulaire ATP. D'où, gastrique H + , K + -Les ATPases sont une cible privilégiée pour les médicaments qui traitent la sécrétion excessive d'acide gastrique.
La principale question de recherche dans ce domaine d'étude est de savoir comment un environnement aussi fortement acide peut être atteint dans l'estomac. Pour répondre à cette question, les chercheurs ont cherché la structure de H + , K + -ATPase. L'équipe a récemment publié ses conclusions dans La nature .
« Dans notre étude, nous avons utilisé la cristallographie aux rayons X pour déterminer les structures de H gastrique + , K + -ATPase liée à deux inhibiteurs de la pompe à protons, vonoprazan et SCH28080, ", explique le premier auteur Kazuhiro Abe. "Ces informations sont importantes à la fois pour le raffinement des médicaments existants et pour la découverte de nouveaux médicaments."
La cristallographie aux rayons X est une technique qui utilise des diagrammes de diffraction des rayons X pour déterminer la haute résolution, structures tridimensionnelles de molécules telles que les protéines, petites molécules organiques, et matériaux.
L'équipe a réussi à résoudre la structure cristalline de H + , K + -ATPase en complexe avec du vonoprazan ou du SCH28080 à une résolution de 2,8 Å - suffisamment élevée pour révéler que les médicaments se chevauchaient partiellement mais avaient des modes de liaison clairement distincts dans leurs sites de liaison trouvés au milieu d'un conduit allant de la lumière gastrique au cation -site de liaison.
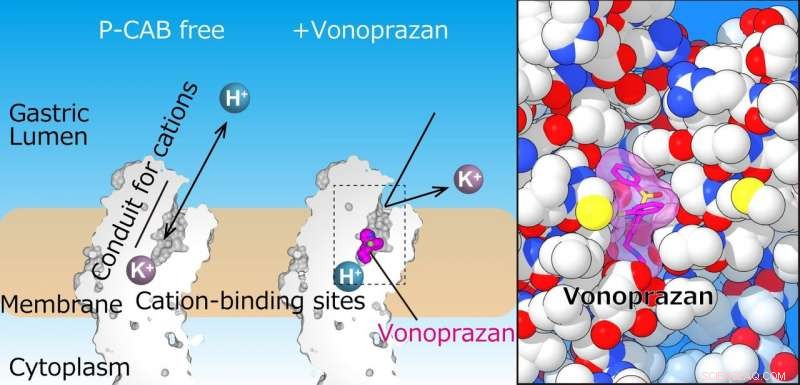
La pompe à protons gastrique exporte H+ dans la lumière gastrique, qui suit l'absorption de K+ dans le cytoplasme. Le panneau de gauche montre des tranches du domaine transmembranaire de la pompe à protons gastrique. Dans la structure actuelle, P-CAB (vonoprazan, magenta) se lie au milieu de la voie de transport des cations (conduit), qui bloque le transport des cations. La vue agrandie du site de liaison du vonoprazan (magenta) révèle sa liaison étroite à la protéine (à droite). Crédit :Kazuhiro Abe
"Les structures cristallines suggèrent que la configuration serrée au niveau du site de liaison des cations abaisse suffisamment la valeur pKa (une mesure de la force acide) de l'acide glutamique au résidu 820 pour permettre la libération d'un proton même dans l'environnement à pH 1 de l'estomac, ", déclare l'auteur principal Yoshinori Fujiyoshi. "Ces structures définissent l'interaction moléculaire entre les P-CAB (K + -bloquants acides compétitifs) et H + , K + -ATPase, et révéler comment H + , K + -ATPase expulse H + dans l'estomac même à pH1. Ces informations contribueront de manière significative à la base de connaissances pour la découverte de médicaments pour les conditions liées à l'acidification excessive de l'estomac."
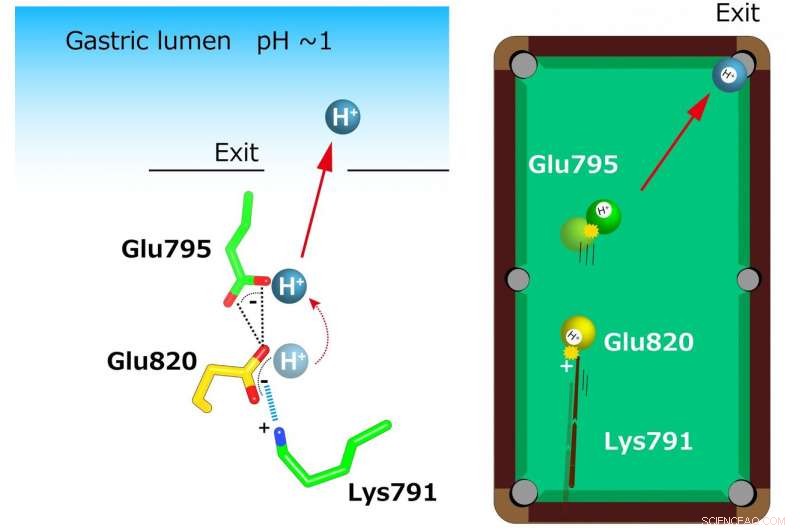
Une coordination inhabituellement étroite de deux glutamates (Glu795 et Glu820) et d'une lysine (Lys791) au site de liaison du cation a été révélée dans la structure cristalline. Un seul H+ lié à Glu820 est extrudé par la charge positive de Lys791, même pour la lumière gastrique très acide (à gauche). Ce mécanisme est assimilé à un modèle de billard (à droite). Une charge positive au niveau du résidu lysine agit comme un "signal" qui tire la "boule jaune" (H+) à Glu820. Cette boule jaune heurte à son tour un autre H+ (boule verte) à Glu795 qui est exposé à la voie de transport des cations. Finalement, une seule boule (H+) se trouve dans la poche (sortie vers la lumière gastrique). Crédit :Kazuhiro Abe