Crédit :Université de Portsmouth
Les scientifiques ont mis au point une enzyme capable de digérer certains de nos plastiques les plus polluants, offrant une solution potentielle à l'un des plus grands problèmes environnementaux du monde.
La découverte pourrait déboucher sur une solution de recyclage pour des millions de tonnes de bouteilles en plastique, en polyéthylène téréphtalate, ou PET, qui persiste actuellement pendant des centaines d'années dans l'environnement.
La recherche a été menée par des équipes de l'Université de Portsmouth et du National Renewable Energy Laboratory (NREL) du département américain de l'Énergie et est publiée dans Actes de l'Académie nationale des sciences ( PNAS ).
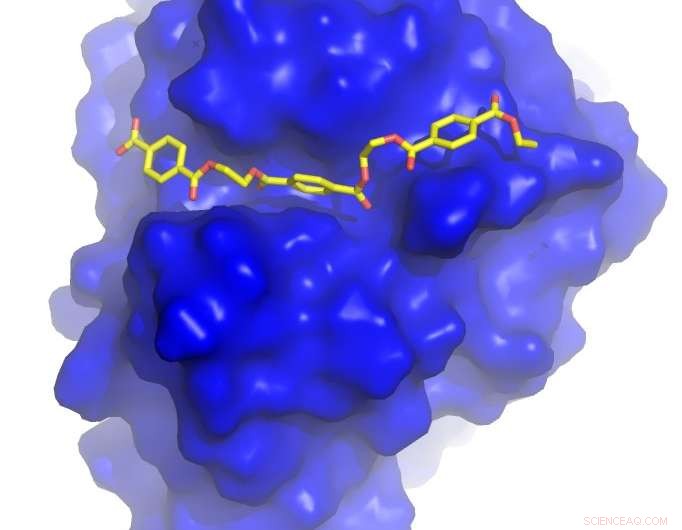
Le professeur John McGeehan de l'Université de Portsmouth et le Dr Gregg Beckham du NREL ont résolu la structure cristalline de la PETase - une enzyme récemment découverte qui digère le PET - et ont utilisé ces informations 3D pour comprendre son fonctionnement. Au cours de cette étude, ils ont conçu par inadvertance une enzyme qui dégrade encore mieux le plastique que celle qui a évolué dans la nature.
Les chercheurs travaillent maintenant à améliorer davantage l'enzyme pour lui permettre d'être utilisée industriellement pour décomposer les plastiques en une fraction du temps.
Professeur McGeehan, Directeur de l'Institut des sciences biologiques et biomédicales de l'École des sciences biologiques de Portsmouth, a déclaré:"Peu de gens auraient pu prédire que depuis que les plastiques sont devenus populaires dans les années 1960, d'énormes plaques de déchets plastiques flotteraient dans les océans, ou échoués sur des plages autrefois immaculées du monde entier.
« Nous pouvons tous jouer un rôle important dans la résolution du problème du plastique, mais la communauté scientifique qui a finalement créé ces « matériaux merveilleux », doivent désormais utiliser toute la technologie à leur disposition pour développer de vraies solutions. »
Les chercheurs ont fait une percée en examinant la structure d'une enzyme naturelle qui aurait évolué dans un centre de recyclage des déchets au Japon, permettant à une bactérie de dégrader le plastique comme source de nourriture.
ANIMAUX, breveté comme plastique dans les années 40, n'existe pas dans la nature depuis très longtemps, l'équipe a donc entrepris de déterminer comment l'enzyme a évolué et s'il serait possible de l'améliorer.
Le but était de déterminer sa structure, mais ils ont fini par aller plus loin et ont accidentellement conçu une enzyme qui était encore meilleure pour décomposer les plastiques PET.
"La sérendipité joue souvent un rôle important dans la recherche scientifique fondamentale et notre découverte ici ne fait pas exception, " dit le professeur McGeehan.
« Bien que l'amélioration soit modeste, cette découverte imprévue suggère qu'il est possible d'améliorer encore ces enzymes, nous rapprochant d'une solution de recyclage pour la montagne sans cesse croissante de plastiques mis au rebut."
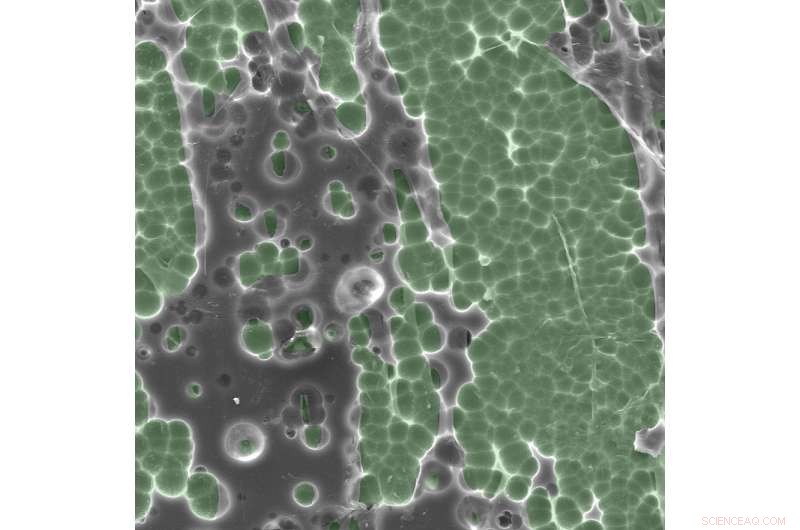
Photos au microscope électronique des interactions enzyme/substrat. Crédit :Dennis Schroeder / NREL
L'équipe de recherche peut désormais appliquer les outils de l'ingénierie et de l'évolution des protéines pour continuer à l'améliorer.
L'Université de Portsmouth et le NREL ont collaboré avec des scientifiques de la Diamond Light Source au Royaume-Uni, un synchrotron qui utilise des faisceaux intenses de rayons X 10 milliards de fois plus brillants que le soleil pour agir comme un microscope suffisamment puissant pour voir des atomes individuels.
En utilisant leur dernier laboratoire, ligne de lumière I23, un modèle 3D ultra-haute résolution de l'enzyme PETase a été généré dans les moindres détails.
Le professeur McGeehan a déclaré :« La source lumineuse Diamond a récemment créé l'une des lignes de faisceaux à rayons X les plus avancées au monde et l'accès à cette installation nous a permis de voir la structure atomique 3D de la PETase avec des détails incroyables. Pouvoir voir le fonctionnement interne de ce catalyseur biologique nous a fourni les plans pour concevoir une enzyme plus rapide et plus efficace. »
Directeur général de Diamond Light Source, Professeur Andrew Harrison, a déclaré : « Avec la contribution de cinq institutions dans trois pays différents, cette recherche est un bel exemple de la façon dont la collaboration internationale peut aider à faire des percées scientifiques importantes.
« Les détails que l'équipe a pu tirer des résultats obtenus sur la ligne de lumière I23 à Diamond seront inestimables pour chercher à adapter l'enzyme à une utilisation dans des processus de recyclage industriels à grande échelle. L'impact d'une solution aussi innovante sur les déchets plastiques serait mondial. C'est fantastique que les scientifiques et les installations britanniques aident à montrer la voie. "
Avec l'aide des scientifiques en modélisation informatique de l'Université de Floride du Sud et de l'Université de Campinas au Brésil, l'équipe a découvert que la PETase ressemble beaucoup à une cutinase, mais il a quelques caractéristiques inhabituelles, y compris un site actif plus ouvert, capable d'accueillir des polymères artificiels plutôt que naturels. Ces différences indiquent que la PETase peut avoir évolué dans un environnement contenant du PET pour permettre à l'enzyme de dégrader le PET. Pour tester cette hypothèse, les chercheurs ont muté le site actif de la PETase pour le faire ressembler davantage à une cutinase.
Et c'est alors que l'inattendu s'est produit - les chercheurs ont découvert que le mutant de la PETase était meilleur que la PETase naturelle pour dégrader la PET.
Significativement, l'enzyme peut également dégrader le polyéthylène furandicarboxylate, ou PEF, un substitut biosourcé aux plastiques PET qui est salué comme un remplacement des bouteilles de bière en verre.
Le professeur McGeehan a déclaré :« Le processus d'ingénierie est à peu près le même que pour les enzymes actuellement utilisées dans les détergents de bio-lavage et dans la fabrication de biocarburants - la technologie existe et il est tout à fait possible que dans les années à venir, nous voyions une solution industriellement viable procédé pour transformer le PET et potentiellement d'autres substrats comme le PEF, PLA, et PBS, dans leurs blocs de construction d'origine afin qu'ils puissent être recyclés de manière durable."
L'auteur principal de l'article est un étudiant de troisième cycle financé conjointement par l'Université de Portsmouth et le NREL, Harry Austin.
Il a déclaré :« Cette recherche n'est qu'un début et il reste encore beaucoup à faire dans ce domaine. Je suis ravi de faire partie d'une équipe internationale qui s'attaque à l'un des plus gros problèmes auxquels notre planète est confrontée.