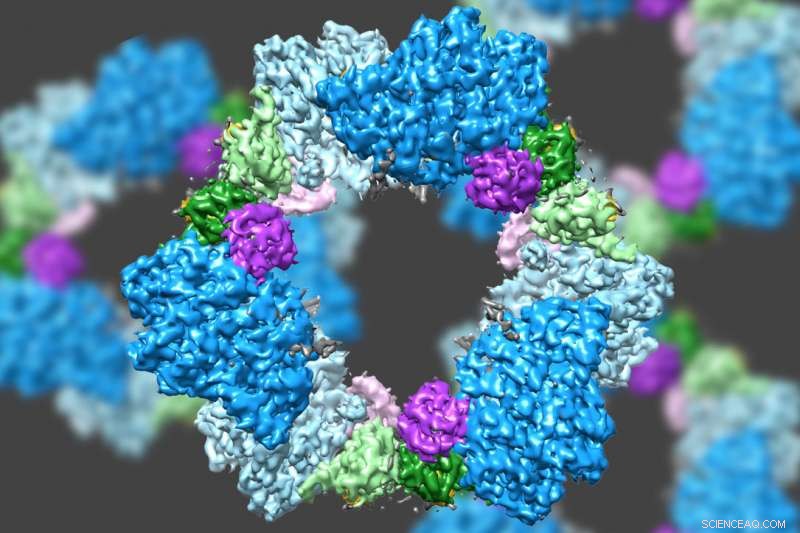
En utilisant un type de microscopie électronique de pointe, une équipe dirigée par le MIT a découvert la structure d'une enzyme qui est cruciale pour maintenir un approvisionnement adéquat en éléments constitutifs de l'ADN dans les cellules humaines. Crédit :Massachusetts Institute of Technology
En utilisant un type de microscopie électronique de pointe, une équipe dirigée par le MIT a découvert la structure d'une enzyme qui est cruciale pour maintenir un approvisionnement adéquat en éléments constitutifs de l'ADN dans les cellules humaines.
Leur nouvelle structure révèle également le mécanisme probable de la façon dont les cellules régulent l'enzyme, connue sous le nom de ribonucléotide réductase (RNR). Significativement, le mécanisme semble différent de celui de la version bactérienne de l'enzyme, suggérant qu'il pourrait être possible de concevoir des antibiotiques qui bloquent sélectivement l'enzyme bactérienne.
"Les gens ont essayé de comprendre s'il y avait quelque chose d'assez différent pour inhiber les enzymes bactériennes et non la version humaine, " dit Catherine Drennan, professeur de chimie et de biologie au MIT et chercheur au Howard Hughes Medical Institute. "En considérant ces enzymes clés et en déterminant quelles sont les différences et les similitudes, nous pouvons voir s'il y a quelque chose dans l'enzyme bactérienne qui pourrait être ciblé avec des médicaments à petites molécules. »
Drennan est l'un des auteurs principaux de l'étude, qui paraît dans le numéro du 20 février de la revue eLife . JoAnne Stubbe, le professeur émérite de chimie Novartis au MIT, et Francisco Asturies, professeur agrégé de biochimie à la faculté de médecine de l'Université du Colorado, sont également des auteurs chevronnés. Les auteurs principaux de l'article sont le chercheur scientifique du MIT Edward Brignole et l'ancien postdoctorant du Scripps Research Institute Kuang-Lei Tsai, qui est maintenant professeur adjoint au centre médical de l'Université du Texas à Houston.
Une enzyme inhabituelle
L'enzyme RNR, qui se trouve dans toutes les cellules vivantes, convertit les ribonucléotides (les éléments constitutifs de l'ARN) en désoxyribonucléotides (les éléments constitutifs de l'ADN). Les cellules doivent conserver un stock suffisant de ces briques, mais quand ils en accumulent trop, Le RNR est interrompu par une molécule de désoxynucléotide connue sous le nom de dATP. Lorsque plus de désoxynucléotides sont nécessaires, une molécule apparentée appelée ATP se lie au RNR et le réactive.
Une caractéristique inhabituelle du RNR est qu'il peut catalyser la production de quatre produits différents :les bases nucléotidiques souvent abrégées en A, G, C, et T. En 2016, Drennan a découvert que l'enzyme y parvient en changeant sa forme en réponse aux molécules régulatrices.
La plupart des travaux antérieurs des chercheurs sur la structure RNR se sont concentrés sur la version trouvée dans E. coli . Pour ces études, ils ont utilisé la cristallographie aux rayons X, une technique qui peut révéler la structure atomique et moléculaire d'une protéine après sa cristallisation.
Dans la nouvelle étude, Drennan et ses collègues ont entrepris d'examiner la version humaine de RNR. La structure de cette protéine, qui s'est avérée très différente de la version bactérienne, s'est avéré insaisissable en utilisant la cristallographie aux rayons X, ce qui ne fonctionne pas bien pour les protéines qui ne cristallisent pas facilement. Au lieu, les chercheurs se sont tournés vers une forme avancée de microscopie connue sous le nom de cryo-microscopie électronique (cryo-EM).
Jusque récemment, cryo-EM offrait généralement une résolution d'environ 10 à 20 angströms, qui pourrait révéler la forme globale d'une protéine mais aucun détail sur la position et la forme des unités structurelles plus petites qu'elle contient. Cependant, ces dernières années, les progrès technologiques ont conduit à une explosion du nombre de structures atteignant des résolutions d'environ 3 angströms. C'est assez élevé pour tracer des chaînes de protéines individuelles dans la plus grosse molécule, ainsi que des structures internes telles que des hélices et même des chaînes latérales d'acides aminés.
Les scientifiques savaient déjà que la RNR se compose de deux sous-unités protéiques appelées alpha et bêta. En utilisant cryo-EM, l'équipe du MIT a découvert que la version humaine de l'enzyme forme un anneau composé de six des sous-unités alpha. Lorsque l'ATP, qui active RNR, est lié à l'enzyme, l'anneau est instable et peut être facilement ouvert, permettant à la sous-unité bêta de se frayer un chemin dans l'anneau. Cette jonction d'alpha et bêta permet au site actif de l'enzyme, situé dans la sous-unité bêta, pour effectuer les réactions chimiques nécessaires à la production de désoxynucléotides.
Cependant, lorsque l'inhibiteur dATP est présent, l'anneau devient beaucoup plus rigide et ne permet pas à la sous-unité bêta d'entrer. Cela empêche l'enzyme de catalyser la production de désoxynucléotides.
Concevoir des médicaments
Plusieurs médicaments anticancéreux actuellement utilisés ou en développement ciblent la version humaine du RNR, interférer avec la capacité des cellules cancéreuses à se reproduire en limitant leur approvisionnement en éléments constitutifs de l'ADN. L'équipe du MIT a trouvé des preuves qu'au moins un de ces médicaments, diphosphate de clofarabine, fonctionne en induisant la formation d'anneaux alpha rigides à 6 unités.
Cet anneau à 6 unités ne se trouve pas dans la forme bactérienne de RNR, qui s'assemble à la place en un anneau distinct contenant quatre sous-unités alpha et quatre sous-unités bêta. Cela signifie qu'il pourrait être possible de concevoir des antibiotiques qui ciblent la version bactérienne mais pas la version humaine, dit Drennan.
Elle envisage maintenant d'étudier les structures d'autres molécules protéiques difficiles à étudier avec la cristallographie aux rayons X, y compris les protéines avec des amas fer-soufre, que l'on retrouve dans de nombreuses voies métaboliques. Le travail de microscopie dans cette étude a été effectué au Scripps Research Institute, mais lorsque le nouveau bâtiment MIT.nano du MIT ouvrira, il abritera deux microscopes cryo-EM qui seront mis à la disposition de la communauté du MIT ainsi que d'autres utilisateurs potentiels dans l'industrie et le milieu universitaire.
« Les avancées technologiques qui ont permis à la cryo-EM d'atteindre une résolution aussi élevée sont vraiment passionnantes, " dit Drennan. " Cela commence vraiment à révolutionner l'étude de la biologie. "