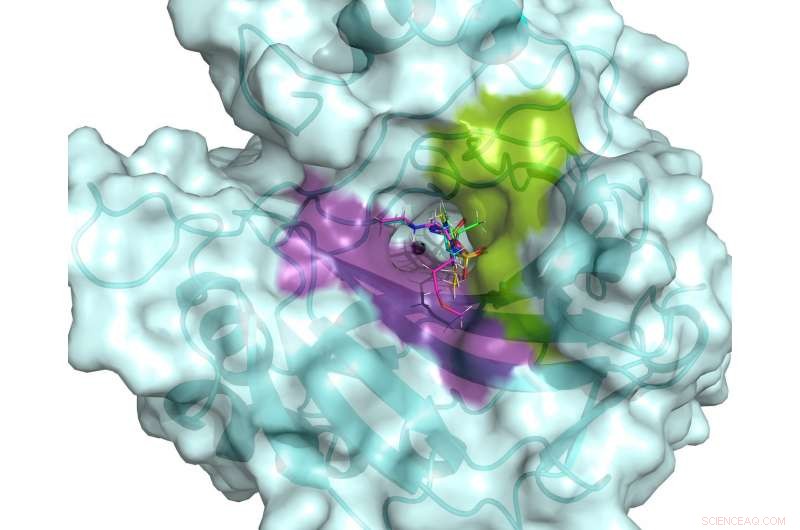
Le site actif de hCA II. Le site actif est flanqué de poches de liaison hydrophiles (violet) et hydrophobes (vert) qui peuvent être utilisées pour concevoir des médicaments spécifiques ciblant les hCA associés au cancer. Cinq médicaments cliniques sont montrés superposés dans le site actif de hCA II, basé sur des structures neutroniques à température ambiante. Crédit :ORNL/Andrey Kovalevsky
De nouvelles connaissances issues de l'analyse neutronique des médicaments contre le glaucome et de leur cible enzymatique pourraient aider les scientifiques à concevoir des médicaments qui ciblent plus efficacement les cancers agressifs.
Une équipe de chercheurs dirigée par le laboratoire national d'Oak Ridge du ministère de l'Énergie a utilisé la cristallographie macromoléculaire neutronique pour étudier les différents états de trois médicaments contre le glaucome lorsqu'ils interagissent avec l'enzyme ciblée, l'anhydrase carbonique humaine II (hCA II).
"Notre objectif était d'observer des différences dans la présentation de trois médicaments contre le glaucome utilisés en clinique alors qu'ils sont liés à l'enzyme hCA II, " a déclaré Andrey Kovalevsky, un scientifique des instruments à l'ORNL et un co-auteur principal de l'étude. « En examinant dans quelle mesure ces médicaments ciblent l'hCA II sous forme protonée, états neutres et déprotonés, nous espérions obtenir des informations qui permettraient d'améliorer ces médicaments afin qu'ils puissent mieux cibler les enzymes liées au cancer."
La protonation fait référence à la présence, addition ou perte d'un proton, qui donne au médicament une neutralité, charge positive ou négative, respectivement. La modification de la charge d'un médicament pourrait modifier sa capacité à reconnaître et à se lier à sa protéine cible et, par conséquent, son efficacité.
L'étude, publié dans la revue Structure , trouvé cette température, pH, et la charge électrique des trois médicaments contre le glaucome a affecté leur capacité à cibler et à se lier à l'enzyme hCA II.
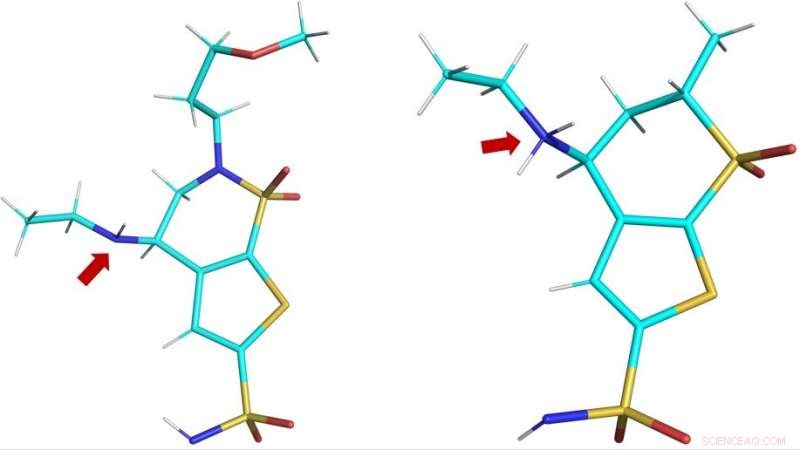
Structures tridimensionnelles des médicaments cliniques brinzolamide (BZM, à gauche) etdorzolamide (DZM, à droite) comme observé dans le site actif de hCA II. La flèche rouge montre les groupes aminés des médicaments :dans BZM, l'atome d'azote (en bleu) n'est pas protoné et donc non chargé; en DZM, l'atome d'azote a accepté un proton supplémentaire et est donc chargé positivement. Crédit :ORNL/Andrey Kovalevsky
"Cette découverte était vraiment une preuve de principe pour nous, " a déclaré Robert McKenna, professeur à l'Université de Floride et co-auteur principal de l'étude. "Cela nous a ouvert les yeux sur l'impact des changements de température et de pH sur l'état de protonation du médicament, ce qui à son tour le rend plus ou moins efficace."
De nouvelles informations sur les réseaux de liaisons hydrogène qui constituent le site actif de l'hCA II pourraient aider d'autres scientifiques à développer de nouveaux et meilleurs médicaments pour le traitement du cancer. La famille des enzymes hCA contient des protéines similaires, tels que hCA IX et XII, qui sont associés à des cancers du sein agressifs, comme le cancer du sein triple négatif.
"Nous voulons exploiter la différence de charge, pH et température pour voir si nous pouvons concevoir des médicaments plus efficaces pour cibler ces enzymes, " a déclaré Kovalevsky. " Si nous pouvons comprendre la liaison au niveau atomique, nous pouvons reconcevoir des médicaments et les transformer en « aimants » plus puissants et plus sélectifs qui seront attirés par les enzymes associées au cancer. De tels médicaments seraient beaucoup plus efficaces pour tuer les cellules cancéreuses tout en laissant les cellules saines indemnes, ce qui réduit considérablement les effets secondaires pour les patients."
De nombreux scientifiques ont utilisé la cristallographie aux rayons X pour analyser les structures des enzymes hCA, mais ces études manquent d'informations atomiques complètes sur la liaison aux médicaments en raison de l'incapacité des rayons X à visualiser les atomes d'hydrogène abondants dans les protéines et les enzymes.
Les neutrons sont sensibles aux éléments plus légers, ils fournissent donc des informations beaucoup plus détaillées sur l'emplacement des atomes d'hydrogène. Voir l'hydrogène est essentiel pour étudier les états de protonation d'une enzyme et d'un ligand - une molécule qui se lie à une macromolécule biologique - et pour analyser l'architecture des réseaux de liaison hydrogène. Les neutrons offrent également d'autres avantages expérimentaux.
"Lorsque vous utilisez la diffraction des neutrons, vous n'avez pas de dommages dus aux radiations, pour que vous puissiez faire votre étude à température ambiante, " dit McKenna. " De plus, les cristaux de congélation peuvent altérer le médicament et l'enzyme, introduire une fausse vue dans l'étude, tandis que les études à température ambiante ressemblent plus à l'environnement dans lequel le médicament sera utilisé."