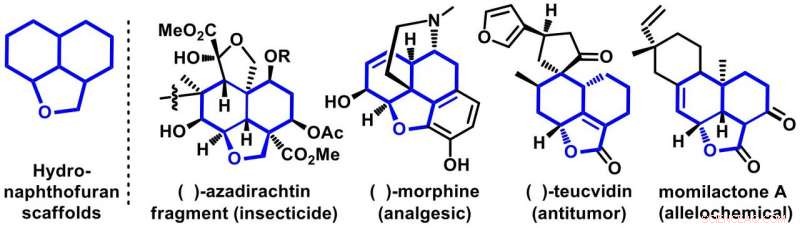
Figure 1. Exemples représentatifs de molécules bioactives ayant des échafaudages d'hydronaphthofuranes. Crédit :Université d'Osaka
Des chercheurs de l'Université d'Osaka ont développé un moyen très efficace de produire des composés tricycliques fusionnés multicentriques chiraux dont la structure centrale se trouve souvent dans les composés bioactifs, y compris les médicaments.
Les chimistes ont consacré d'énormes efforts pour développer un moyen de construire des molécules comme ils le souhaitent. Un seul énantiomère (arrangement spécial spécifique d'atomes) est essentiel pour les molécules de propriétés biomédicales spécifiques en raison de la nature chirale des sites récepteurs biologiques (généralement des protéines). Un objectif très difficile en chimie organique est la synthèse asymétrique, préparation sélective d'un seul énantiomère d'une molécule.
Récemment, des chimistes de l'Université d'Osaka ont synthétisé des composés chiraux polycycliques hautement énantiosélectifs avec de multiples centres chiraux d'une manière élégante et sélective qui pourraient ouvrir de nouvelles voies dans la recherche et l'industrie.
Dans leur rapport en Communication Nature , l'équipe d'Osaka s'est concentrée sur le développement d'un moyen nouveau et pratique de synthétiser des molécules tricycliques, appelés hydronaphtofuranes. Ces échafaudages sont abondants en produits naturels d'activités biologiques importantes. Les membres représentatifs de cette famille sont la morphine, azadirachtine, la teucvidine et la momilacton qui sont bien connues pour montrer une gamme d'activités biologiques telles que l'analgésique, anti-tumoral, insecticides, et allélochimiques (Figure 1). Bien que certains se trouvent dans la nature, les préparer en laboratoire de synthèse avec un contrôle complet de la sélectivité est un défi majeur pour les chimistes de synthèse.
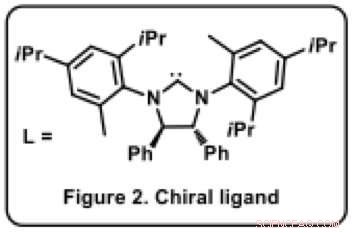
Figure 2. Ligand chiral. Crédit :Université d'Osaka
Une synthèse rapportée par un groupe espagnol a utilisé un catalyseur chiral à base de molécules organiques pour produire un échafaudage tricyclique avec trois centres chiraux. D'autre part, l'équipe d'Osaka a adopté une stratégie conceptuelle différente pour construire l'échafaudage tricyclique avec cinq centres chiraux (Schéma 1). Partant d'une matière première bon marché avec un seul anneau (phénols), ils ont utilisé un catalyseur chiral à base de nickel organométallique pour construire deux autres anneaux par une réaction appelée cyclisation oxydative (1 à 2). Le déplacement in situ du nickel d'un intermédiaire 2 avec une autre molécule réactive de substituants souhaités a donné une variété d'hydronaphtofuranes. Le produit final est formé sous forme d'isomère unique et contient au moins cinq centres chiraux, répartis entre les trois anneaux.
Ravindra Kumar, l'un des membres de l'équipe explique, "Le catalyseur est la clé de la sélectivité chirale, puisqu'il est lui-même chiral." En fait, bien que l'application des catalyseurs au nickel soit très répandue en synthèse organique, aucun n'avait utilisé dans cette réaction auparavant. "Dans un catalyseur organométallique, il est crucial d'attacher un ligand approprié [molécule organique, L*] à l'atome de métal pour déterminer le résultat de la réaction. Le ligand est généralement une molécule organique volumineuse avec plusieurs systèmes cycliques (figure 2). Dans notre cas, il s'agissait d'un processus d'essais et d'erreurs éclairés pour trouver un ligand approprié qui a donné le produit souhaité sous la forme d'un seul composé (sur seize possibles) à la fois avec un rendement élevé et avec une excellente pureté chirale.
Avec le catalyseur approprié en main, l'équipe a produit avec succès plus de vingt composés avec de bons rendements et avec une énantiosélectivité de 94 à 99 % des cinq centres chiraux - un exploit spectaculaire ! Tolérance d'une large gamme de substituants (R) (halogènes, cycles et esters benzéniques) dans la méthode développée et la présence de groupes fonctionnalisables (carbonyles et oléfines) élargissent l'utilité synthétique potentielle des produits tricycliques en molécules bioactives après transformation du groupe fonctionnel. En plus d'offrir une excellente pureté chirale, la réaction est également rapide et économique en matières premières de départ, qui sont des exigences cruciales pour étendre la recherche du laboratoire à la production industrielle.
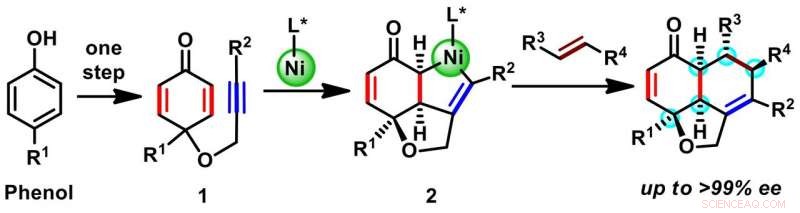
Schéma 1. Synthèse énantiosélective en deux étapes d'échafaudages d'hydronaphthofuranes. Crédit :Université d'Osaka
"Ces produits tricycliques sont traditionnellement fabriqués par construction cyclique par étapes, mais cela a tendance à être lent et inefficace, " Sensuke Ogoshi, le directeur d'équipe, dit. « Notre cyclisation directe en deux étapes permet d'accéder à une gamme d'échafaudages très utiles pour les produits naturels. A terme, cela pourrait non seulement simplifier la production de médicaments connus, mais peut-être conduire à la découverte de nouveaux composés ayant des propriétés médicinales ou autres propriétés biologiques."