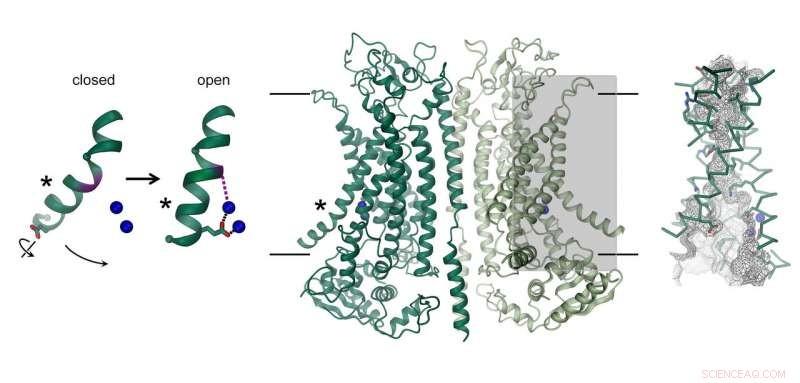
Structure du canal chlorure activé par le calcium TMEM16A. La chaîne, qui se compose de deux sous-unités identiques, est représenté au centre. La position de la membrane est indiquée par des lignes. Le pore de conduction ionique est mis en évidence (rectangle gris) et illustré en détail à droite. L'image de gauche montre le mouvement d'une hélice menant à l'ouverture du canal. Les ions calcium liés sont représentés par des sphères bleues. Crédit :Raimund Dutzler, UZH
Des biochimistes de l'Université de Zurich ont utilisé la cryomicroscopie électronique pour déterminer l'architecture détaillée du canal chlorure TMEM16A. Cette protéine est une cible prometteuse pour le développement de médicaments efficaces pour traiter la mucoviscidose.
La mucoviscidose est une maladie héréditaire grave du poumon, pour lequel il n'existe actuellement aucun remède. La cause sous-jacente de la maladie est un dysfonctionnement du canal chlorure CFTR, qui empêche la sécrétion de chlorure dans certaines cellules du corps. Cela conduit à une déshydratation de la couche de mucus dans les poumons. Une approche prometteuse pour le traitement de la mucoviscidose est l'activation du canal chlorure activé par le calcium TMEM16A comme voie alternative pour l'efflux de chlorure. Puisque TMEM16A est exprimé dans le même épithélium que CFTR, son activation pourrait restaurer l'hydratation de la couche de mucus. TMEM16A fait partie d'une famille de protéines dont les membres facilitent le flux d'ions chlorure ou de lipides chargés négativement à travers la membrane cellulaire.
Structure d'un canal chlorure déterminée
La structure d'un brouillage TMEM16, qui fonctionne comme un transporteur de lipides et joue un rôle important dans la coagulation du sang, était déjà connu par des travaux antérieurs. Des chercheurs du Département de biochimie de l'Université de Zurich ont désormais également réussi à décrypter la structure du canal chlorure TMEM16A. Faire cela, l'équipe dirigée par le professeur Raimund Dutzler a utilisé la cryomicroscopie électronique (cryo-EM), une technique dont les pionniers ont récemment reçu le prix Nobel de chimie. « L'architecture moléculaire de cette protéine membranaire est cruciale pour le développement ciblé de médicaments pour le traitement de la mucoviscidose, " souligne Dutzler.
Découverte d'un nouveau mécanisme d'activation
Le canal chlorure TMEM16A se trouve dans différents organes du corps et joue un rôle clé dans la sécrétion de chlorure dans les poumons, la contraction des muscles lisses, et la perception de la douleur. La façon dont sa structure diffère des scramblases étroitement apparentées de la même famille et comment la protéine est activée par le calcium a maintenant été révélée grâce à une combinaison de cryo-EM et d'électrophysiologie. Alors que son architecture générale ressemble à des brouillons de la même famille, il existe des différences distinctes dans la région des pores située dans chaque sous-unité de la protéine dimère. Les Scramblases contiennent un sillon polaire exposé à la membrane, qui permet la diffusion de groupes de tête lipidiques à travers la bicouche lipidique. En revanche, au même endroit, TMEM16A forme un canal protéiné en forme de sablier, qui est fermé en l'absence de calcium. La liaison d'ions calcium chargés positivement à proximité ouvre le canal et permet aux ions chlorure chargés négativement de traverser la membrane. "Ce mécanisme d'activation est unique, puisque les ions calcium liés modifient directement la structure et l'électrostatique du pore de perméation ionique, " explique Cristina Paulino, auteur principal de l'étude.
Ouvrir la voie à de nouvelles thérapies
Les découvertes qui décrivent la structure et la fonction de TMEM16A ouvrent la voie à une compréhension mécanistique de cette importante famille de protéines membranaires, et ils fournissent un modèle prometteur pour le développement de médicaments pour le traitement de la mucoviscidose. « Des substances conduisant à l'activation du TMEM16A compenseraient le défaut de sécrétion des ions chlorure dans le poumon, " déclare Raimund Dutzler.