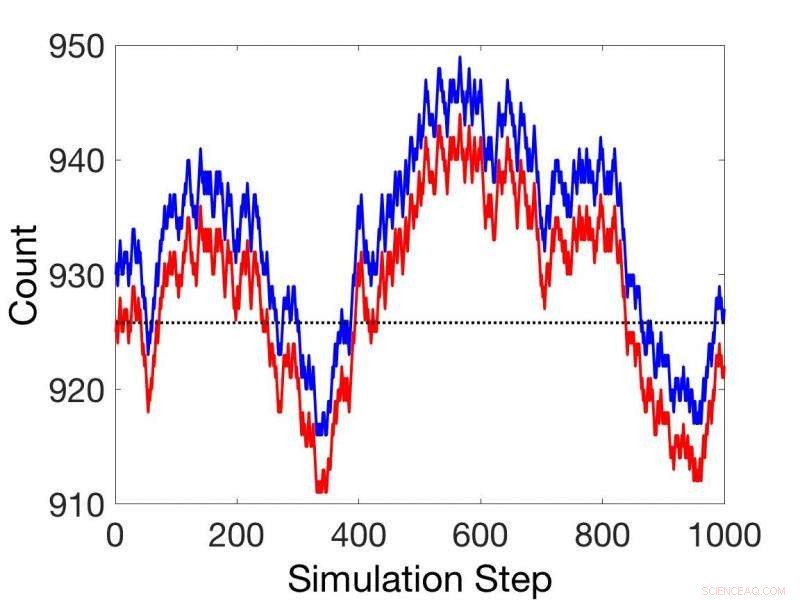
Comparaisons entre les simulations cinétiques stochastiques en régime non stationnaire (rouge) et les simulations utilisant le théorème de réaction couplée (bleu). Crédit :Laboratoire national du Nord-Ouest du Pacifique
La loi de l'action de masse a été décrite pour la première fois il y a 150 ans. Aujourd'hui, c'est toujours un concept de base dans chaque texte de chimie de première année. La loi stipule que la vitesse d'une réaction chimique est proportionnelle à la concentration des réactifs. Pour les solutions en équilibre dynamique, la loi prédit le comportement de ces solutions.
Mais c'est un défi d'appliquer la loi d'action de masse à des systèmes complexes, comme le métabolisme biologique. Pour un, la plupart des constantes de vitesse ne sont pas disponibles, et mesurer les manquants est très laborieux.
En recherche biologique, mesurer les constantes de vitesse nécessite d'isoler et de purifier des enzymes individuelles, puis déterminer les constantes de vitesse avec la spectrophotométrie - c'est-à-dire, de la quantité de lumière absorbée par un produit chimique. Cela ralentit les vitesses de débit, rendant difficile la caractérisation de chaque nouveau génome. Après tout, pour ce faire, il faut des milliers de paramètres de taux.
En raison de ces problèmes, un grand nombre de paramètres de taux enzymatiques ont été déterminés pour quelques systèmes bien décrits, comme Escherichia coli. Pour la plupart des systèmes biologiques, les scientifiques n'ont pas encore obtenu de constantes de vitesse.
Pendant ce temps, la méthode de choix pour modéliser des processus biologiques à grande échelle (comme le métabolisme) implique des modèles de flux basés sur des contraintes. Mais ces modèles souffrent d'un manque de physique concernant la loi d'action de masse, limiter la capacité des approches basées sur les contraintes même lorsqu'elles sont étendues pour inclure la thermodynamique et d'autres facteurs.
En réponse, certains chercheurs ont proposé d'étudier les réactions élémentaires en utilisant la loi de la réaction de masse par affinités de réaction au lieu de constantes de vitesse.
Un nouvel article dans la revue Biologie physique par William R. Cannon et Scott E. Baker du Pacific Northwest National Laboratory examine la relation entre l'affinité de réaction et l'énergie libre pour des réactions isolées en utilisant des concepts d'intégration thermodynamique statistique. Cannon et Baker ont entrepris de démontrer explicitement la relation entre les formulations cinétiques de vitesses qui utilisent des constantes de vitesse et une formulation de thermodynamique statistique qui utilise des potentiels chimiques.
Par la suite, ils présentent un théorème pour les réactions couplées basé sur les potentiels chimiques, qui peut fournir des taux relatifs pour toutes les réactions couplées séquentiellement dans toutes les conditions, état stable ou non. Cela évite le besoin de constantes de vitesse dans de nombreuses applications.
L'utilisation de potentiels chimiques au lieu de constantes de vitesse représente un saut méthodologique qui, selon les auteurs, pourrait signaler une avancée majeure pour la modélisation prédictive en biologie des systèmes.
La nouvelle méthode permettra des complexes, systèmes biologiques à grande échelle tels que le métabolisme à modéliser avec la cinétique et la thermodynamique. Cela se traduira par des prédictions plus précises pour la conception des micro-organismes pour qu'ils se comportent de la manière souhaitée, comme celles qui pourraient être exploitées pour produire des biocarburants.
De plus, les auteurs disent, la nouvelle méthode apportera un éclairage fondamental sur le couplage thermodynamique entre les organismes vivants et leur environnement.