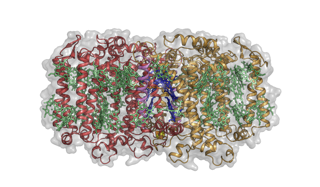
Structure du photosystème-centre de réaction photosynthétique Heliobacterium modesticaldum. Crédit :Christophe Gisriel
Une équipe de scientifiques de l'École des sciences moléculaires de l'ASU et de l'Université d'État de Pennsylvanie nous a permis de faire un pas de plus vers la découverte des secrets de la photosynthèse, et éventuellement à des carburants plus propres.
Leur découverte a récemment été publiée en ligne dans Science et décrit la structure d'un centre réactionnel (issu d'une héliobactérie) qui conserve les caractéristiques de l'ancestral, et fournit ainsi un nouvel aperçu de l'évolution de la photosynthèse.
La photosynthèse est le processus biologique le plus important de la biosphère. Il exploite l'énergie de la lumière du soleil, et nous fournit nos principales sources de nourriture et de carburant. L'étude de la photosynthèse a permis aux scientifiques non seulement de comprendre les subtilités de la façon dont les organismes utilisent la lumière pour piloter leur métabolisme, mais a également ouvert la voie à des avancées technologiques dans les sources d'énergie durables.
"Le processus photosynthétique est apparu il y a environ 3 milliards d'années, avant que l'atmosphère terrestre ne contienne de l'oxygène, " a déclaré Kevin Redding, professeur à l'École des sciences moléculaires du Collège des arts libéraux et des sciences, dont le groupe dirige la recherche à l'ASU. "La photosynthèse fonctionne en utilisant des protéines membranaires spécialisées, appelés centres de réaction photosynthétiques, qui collectent l'énergie de la lumière et l'utilisent pour pomper des électrons à travers une membrane biologique d'un porteur d'électrons cellulaire à un autre, résultant en la conversion de l'énergie électromagnétique (c'est-à-dire lumineuse) en énergie chimique, que l'organisme peut utiliser."
De nombreuses recherches ont déterminé que ces centres de réaction ne sont apparus qu'une seule fois sur la planète, et se sont depuis diversifiés pour effectuer différentes sortes de chimie.
Malgré la diversification, les centres réactionnels conservent la même architecture globale, reflétant leur origine commune. Au cours des 3 derniers milliards d'années, ces protéines ont été élaborées et modifiées et il a été difficile de reconstituer ce qui s'est passé au cours de cette énorme période de temps. Cependant, nous savons que l'un d'eux a développé la capacité d'oxyder l'eau, libérant de l'oxygène. Cela a changé le monde de manière irrévocable, et permis la vie telle que nous la connaissons aujourd'hui.
L'équipe pense que le premier centre de réaction (RC) était beaucoup plus simple que les versions qui existent aujourd'hui. En termes de structure protéique, c'était un homodimère, c'est-à-dire deux copies du même polypeptide se sont réunies pour former une structure symétrique. Les centres réactionnels dont nous connaissons les structures sont tous des hétérodimères dans lesquels cette symétrie inhérente a été brisée, bien qu'à leur cœur, ils conservent encore les vestiges de l'architecture symétrique d'origine.
L'héliobactérie de l'article dans Science est un membre de la plus primitive des bactéries photosynthétiques, bactéries qui ne fabriquent pas d'oxygène - en fait, ils sont complètement intolérants à l'oxygène, comme les premiers organismes. Ils ne peuvent pas non plus fixer le dioxyde de carbone de l'atmosphère et doivent utiliser des sources de carbone organique. Important pour cette étude, leur RC est un homodimère.
Ainsi, il s'agit de la première structure RC homodimérique et elle éclaire de plusieurs manières à quoi pouvait ressembler la RC ancestrale. À plusieurs égards, l'architecture globale de la protéine est très similaire aux photosystèmes des plantes et des cyanobactéries et au RC des bactéries pourpres au soufre. Cependant, construites sur cette architecture commune sont des différences chimiques cruciales qui se traduisent par une chimie différente de celle des RC connus, y compris leur capacité à utiliser à la fois des supports hydrosolubles et liposolubles, une capacité que l'on pensait auparavant limitée à l'un ou l'autre type de RC.
Ce travail est le résultat d'une collaboration entre Kevin Redding, Raimund Fromme, professeur agrégé de recherche à la Faculté des sciences moléculaires et chercheur au Centre de biologie structurale appliquée du Biodesign Institute, et John Golbeck de l'Université d'État de Pennsylvanie.
Redding et Golbeck avaient décidé il y a 8 ans d'unir leurs forces pour lutter contre le RC héliobactérien. Ils ont combiné leurs subventions individuelles du ministère de l'Énergie en une subvention conjointe, qui a depuis été renouvelé deux fois :la troisième itération a commencé il y a un an. Fromme a officiellement rejoint le groupe il y a environ 4 ans, bien qu'il ait travaillé auparavant sur la cristallographie du RC avec Iosifina Sarrou, un post-doctorant du groupe Redding qui avait optimisé sa purification. Le travail a vraiment décollé lorsque Christopher Gisriel, un doctorant du groupe Redding, commencé à travailler avec Fromme pour cristalliser le RC.
"Je remercie Chris et Raimund d'avoir fait le nécessaire pour obtenir cette structure, " dit Redding, qui est également le directeur du Centre de l'ASU pour la bioénergie et la photosynthèse.
"L'expertise de Raimund dans la cristallisation des protéines membranaires et la solution de leur structure était cruciale. Chris a fait le travail très dur d'améliorer la purification, optimiser les conditions de cristallisation, et emmenant ses cristaux aux lignes de lumière à plusieurs reprises. Et parce que la protéine est intrinsèquement sensible à l'oxygène, il a dû faire toute la purification et la cristallisation dans une boîte à gants !"
"C'est le moment qu'attend un cristallographe, " dit Fromme, expliquant les années qu'il peut prendre pour développer le cristal de protéine parfait adapté aux études aux rayons X.
Redding continua, "Ils ont pu obtenir la qualité de diffraction d'une résolution de ~10 à 2-2,5 Å en quelques années de travail très dur… et puis est venue la tâche herculéenne de résoudre la structure. Chris a commencé avec un modèle très simplifié de à quoi pourrait ressembler le RC, sur la base des similitudes attendues avec le photosystème cyanobactérien I, et ensuite travaillé constamment dessus pendant des mois. Il a dû apprendre de nouveaux logiciels et travailler de longues nuits pour y arriver. Une fois qu'il avait quelque chose qui avait l'air réel, Raimund a été capable de prendre cela et de le pousser au niveau suivant. Et en travaillant ensemble, ils ont produit une structure vraiment magnifique à très haute résolution."
"Chris est un vétéran de l'armée américaine, ayant servi en Afghanistan, " Redding a déclaré. "Il est venu à l'ASU en tant que major de biochimie et a commencé à travailler dans mon laboratoire en tant que chercheur de premier cycle. N'ayant jamais sérieusement envisagé la possibilité d'une carrière dans la recherche auparavant, il ne savait pas au début jusqu'où il voulait aller dans cette voie. Cependant, il y prend vite goût, puis m'a poussé à lui permettre de prendre en charge le projet de cristallographie RC en tant qu'étudiant en Master. Je l'ai mis en garde contre cela, sachant à quel point ce serait difficile et les faibles chances de succès, mais il a persisté, et j'ai fini par céder. Il a ensuite décidé de poursuivre un doctorat. Il soutiendra sa thèse plus tard ce semestre et je ne pourrais pas être plus fier de lui."
"Ce centre de réaction ne se trouve que dans les organismes qui peuvent vivre dans des environnements sans oxygène, comme celle de la Terre primitive, " a déclaré Gisriel. " Ce travail a ouvert la porte aux scientifiques du monde entier pour comparer les caractéristiques du centre de réaction primitif avec celles de centres de réaction plus avancés qui résident dans des organismes tolérants à l'oxygène. Par conséquent, nous obtenons une image plus claire et plus éclairée de la façon dont la nature a optimisé la collecte d'énergie par la lumière."