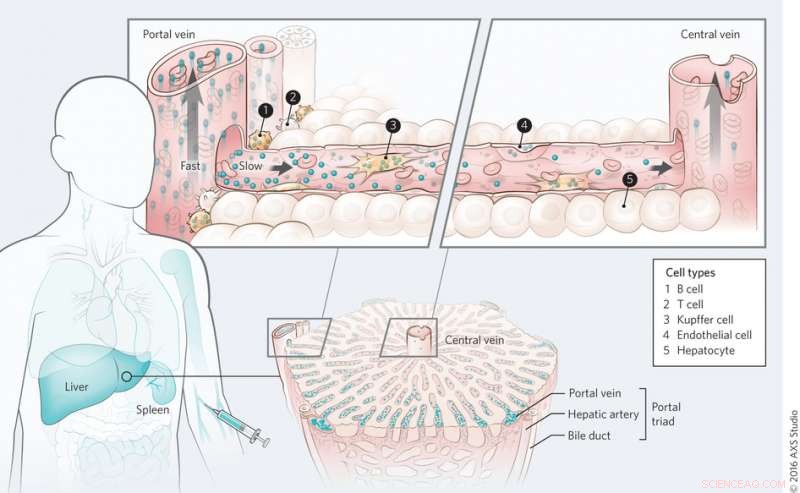
Mécanisme de transport des nanomatériaux dans le foie. Crédit :(c) Kim M. Tsoi, et al. Matériaux naturels (2016) doi:10.1038/nmat4718
(Phys.org)—L'un des plus grands défis pour réaliser le potentiel des thérapies ciblées est d'empêcher les nanomatériaux de s'accumuler dans le foie ou la rate. Le foie et la rate font partie du système phagocytaire mononucléaire. Son travail consiste à filtrer les toxines de la circulation sanguine. Malheureusement, en faisant son travail, elle empêche également les nanothérapies d'atteindre leur cible.
Pour surmonter cet obstacle, un groupe de chercheurs de plusieurs établissements de Toronto a effectué des calculs au niveau des organes et des sous-organes, in vitro, et des études in vivo utilisant des points quantiques, nanoparticules d'or, et des nanoparticules de silice pour mieux comprendre le système phagocytaire mononucléaire et le mécanisme par lequel les nanoparticules sont séquestrées. Ils ont découvert que le débit sanguin, phénotype cellulaire, et la position physique dans le foie jouent tous un rôle dans l'absorption des nanoparticules. Ils suggèrent que les travaux futurs devraient impliquer non seulement la conception de nanoparticules, mais une sorte de pré-conditionnement du foie. Leur travail apparaît dans Matériaux naturels .
Les nanoparticules peuvent être fonctionnalisées de telle manière que la particule cible un type cellulaire particulier. Cela est très prometteur pour le cancer et d'autres thérapies ciblées. Cependant, lorsque les nanothérapies sont testées dans le corps, la nanoparticule est éliminée de la circulation sanguine via le système des phagocytes mononucléaires (MPS). Cela est vrai pour tous les types de nanoparticules.
Tsoi, et al. ont mené des analyses d'organes entiers et de sous-organes pour mieux comprendre comment le système MPS séquestre les nanoparticules. Pour leurs expériences, ils se sont concentrés sur des nanoparticules "dures" non dégradables :points quantiques, nanoparticules d'or, et des nanoparticules de silice.
Au niveau de l'ensemble de l'orgue, Tsoi, et al. ont découvert que les points quantiques sont d'abord effacés par les cellules proches de la triade porte et qu'il existe un gradient de clairance à travers la sinusoïde du foie au cours du premier passage. Le sang entre dans le foie par la triade porte et sort par la veine centrale. Ceci a également été observé avec des nanoparticules d'or indépendamment de la fonctionnalisation de surface, bien que l'adsorption des protéines semble jouer un rôle dans l'absorption des nanoparticules.
Le prochain domaine d'investigation est de savoir si le débit sanguin joue un rôle dans la séquestration des nanoparticules. Le flux sanguin ralentit une fois qu'il atteint le foie (de 10 à 100 cm s -1 à 200-800 m s -1 ). Tsoi, et al. développé un modèle mathématique pour décrire le flux sanguin dans le foie et la probabilité de séquestration des nanoparticules. Ils ont ensuite comparé leurs résultats informatiques aux résultats d'études de cytométrie avec les rats qui ont été traités avec des points quantiques dans le test d'accumulation de nanoparticules. Notamment, tandis que l'advection est l'influence dominante sur le flux sanguin dans le corps, la diffusion est l'influence dominante dans le foie. Ils ont découvert que le foie avait 10 2 à 10 3 fois plus susceptibles de séquestrer les nanomatériaux et que la taille des particules a joué un rôle - plus la particule est grosse, plus il a été absorbé par le foie.
Au niveau des sous-organes, Tsoi, et al. ont examiné quels types de cellules jouent le plus grand rôle dans l'absorption des nanoparticules. Des études visant à déterminer l'absorption cellulaire des points quantiques ont montré que les cellules de Kupffer adsorbaient le plus grand volume de points quantiques, comme prévu. Cependant, ce qui était surprenant, c'était le nombre de particules internalisées par les cellules B. Les cellules B semblent jouer un rôle beaucoup plus important dans l'absorption des nanoparticules qu'on ne le pensait autrefois, bien que les cellules de Kupffer soient toujours les cellules clés pour éliminer les nanoparticules. D'autres types de cellules, y compris les cellules endothéliales, a également joué un rôle dans l'élimination des nanoparticules.
Prochain, Tsoi, et al. testé si l'architecture des organes affecte l'absorption des nanoparticules dans le foie en étudiant le processus de séquestration dans la rate. Ils ont découvert que des nanoparticules qui ont été éliminées par la rate, presque tous étaient situés dans la région de la pulpe rouge. C'est là que le flux sanguin diminue par rapport au flux dans tout le corps. Alors que certaines nanoparticules résidaient dans la rate, les macrophages de la rate ont internalisé moins de nanoparticules que les cellules de Kupffer dans le foie. Ceci a été confirmé par des études comparatives in vitro et in vivo, et démontre que le type cellulaire de l'architecture des organes joue un rôle dans l'absorption des nanoparticules.
Cette recherche fournit des informations importantes sur la façon de surmonter l'absorption de nanoparticules par le MPS. Généralement, les chercheurs se concentrent sur la conception des nanoparticules, mais cette étude suggère que l'environnement corporel joue un rôle important dans la séquestration des nanoparticules. Les auteurs suggèrent de manipuler l'environnement hôte comme stratégie complémentaire à l'optimisation des nanoparticules. Des tests préliminaires montrent que deux voies possibles sont la modification du débit sanguin dans le foie et la modification du phénotype de certaines cellules afin qu'elles ne soient pas sujettes à l'absorption de nanomatériaux.
© 2016 Phys.org