
La couleur d'une suspension de nanocages dépend de l'épaisseur des parois des cages et de la taille des pores de ces parois. Comme leur couleur, leur capacité à absorber la lumière et à la convertir en chaleur peut être contrôlée avec précision. Crédit :WUSTL
Dans une conférence qu'il prononça en 1906, le médecin allemand Paul Ehrlich a inventé le terme Zuberkugel, ou "balle magique, " comme abréviation d'un traitement médical très ciblé.
Balles magiques, aussi appelées balles d'argent, à cause de la croyance folklorique que seules les balles d'argent peuvent tuer des créatures surnaturelles, restent l'objectif des efforts de développement de médicaments aujourd'hui.
Une équipe de scientifiques de l'Université de Washington à St. Louis travaille actuellement sur une solution miracle pour le cancer, une maladie dont les traitements sont notoirement indiscriminés et non spécifiques. Mais leurs balles sont en or plutôt qu'en argent. Littéralement.
Les balles d'or sont des nanocages d'or qui, lorsqu'il est injecté, s'accumulent sélectivement dans les tumeurs. Lorsque les tumeurs sont ensuite baignées de lumière laser, le tissu environnant est à peine réchauffé, mais les nanocages convertissent la lumière en chaleur, tuer les cellules malignes.
Dans un article qui vient d'être publié dans la revue Petit , l'équipe décrit le traitement photothermique réussi des tumeurs chez la souris.
L'équipe comprend Younan Xia, Doctorat., le professeur James M. McKelvey de génie biomédical à la School of Engineering and Applied Science, Michael J. Welch, Doctorat., professeur de radiologie et de biologie du développement à la Faculté de médecine, Jingyi Chen, Doctorat., professeur assistant de recherche en génie biomédical et Charles Glaus, Doctorat., chercheur associé postdoctoral au département de radiologie.
"Nous avons vu des changements significatifs dans le métabolisme et l'histologie de la tumeur, " dit Welch, "ce qui est remarquable étant donné que le travail était exploratoire, la 'dose' laser n'avait pas été maximisée, et les tumeurs étaient ciblées « passivement » plutôt qu'« activement ».
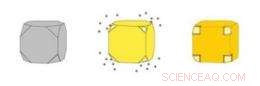
Les nanocages d'or (à droite) sont des boîtes creuses fabriquées en précipitant de l'or sur des nanocubes d'argent (à gauche). L'argent s'érode simultanément de l'intérieur du cube, entrant dans la solution par des pores qui s'ouvrent dans les coins coupés du cube. Crédit :WUSTL
Pourquoi les nanocages chauffent
Les nanocages elles-mêmes sont inoffensives. "Les sels d'or et les colloïdes d'or sont utilisés pour traiter l'arthrite depuis plus de 100 ans, " dit Welch. " Les gens savent ce que fait l'or dans le corps et il est inerte, nous espérons donc que ce sera une approche non toxique. »
"La clé de la thérapie photothermique, " dit Xia, « est la capacité des cages à absorber efficacement la lumière et à la convertir en chaleur. »
Suspensions des nanocages d'or, qui ont à peu près la même taille qu'une particule virale, ne sont pas toujours jaunes, comme on pouvait s'y attendre, mais au lieu de cela peut être n'importe quelle couleur dans l'arc-en-ciel.
Ils sont colorés par ce qu'on appelle une résonance plasmonique de surface. Certains des électrons de l'or ne sont pas ancrés à des atomes individuels mais forment à la place un gaz d'électrons flottant librement, Xia explique. La lumière tombant sur ces électrons peut les conduire à osciller comme un seul. Cette oscillation collective, le plasmon de surface, choisit une longueur d'onde particulière, ou couleur, hors de la lumière incidente, et cela détermine la couleur que nous voyons.
Des artisans médiévaux fabriquaient des vitraux rouge rubis en mélangeant du chlorure d'or dans du verre en fusion, un processus qui a laissé de minuscules particules d'or en suspension dans le verre, dit Xia.
La résonance - et la couleur - peuvent être réglées sur une large gamme de longueurs d'onde en modifiant l'épaisseur des parois des cages. Pour les applications biomédicales, Le laboratoire de Xia règle les cages à 800 nanomètres, une longueur d'onde qui tombe dans une fenêtre de transparence tissulaire comprise entre 750 et 900 nanomètres, in the near-infrared part of the spectrum.
Light in this sweet spot can penetrate as deep as several inches in the body (either from the skin or the interior of the gastrointestinal tract or other organ systems).
The conversion of light to heat arises from the same physical effect as the color. The resonance has two parts. A la fréquence de résonance, light is typically both scattered off the cages and absorbed by them.
By controlling the cages' size, Xia's lab tailors them to achieve maximum absorption.
Passive targeting
"If we put bare nanoparticles into your body, " dit Xia, "proteins would deposit on the particles, and they would be captured by the immune system and dragged out of the bloodstream into the liver or spleen."
Pour éviter cela, the lab coated the nanocages with a layer of PEG, a nontoxic chemical most people have encountered in the form of the laxatives GoLyTELY or MiraLAX. PEG resists the adsorption of proteins, in effect disguising the nanoparticles so that the immune system cannot recognize them.
Instead of being swept from the bloodstream, the disguised particles circulate long enough to accumulate in tumors.
A growing tumor must develop its own blood supply to prevent its core from being starved of oxygen and nutrients. But tumor vessels are as aberrant as tumor cells. They have irregular diameters and abnormal branching patterns, but most importantly, they have thin, leaky walls.
The cells that line a tumor's blood vessel, normally packed so tightly they form a waterproof barrier, are disorganized and irregularly shaped, and there are gaps between them.
The nanocages infiltrate through those gaps efficiently enough that they turn the surface of the normally pinkish tumor black.
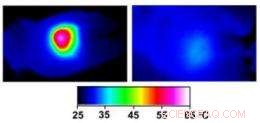
Infrared images made while tumors were irradiated with a laser show that in nanocage-injected mice (left), the surface of the tumor quickly became hot enough to kill cells. In buffer-injected mice (right), the temperature barely budged. This specificity is what makes photothermal therapy so attractive as a cancer therapy. Credit:WUSTL
A trial run
In Welch's lab, mice bearing tumors on both flanks were randomly divided into two groups. The mice in one group were injected with the PEG-coated nanocages and those in the other with buffer solution. Several days later the right tumor of each animal was exposed to a diode laser for 10 minutes.
The team employed several different noninvasive imaging techniques to follow the effects of the therapy. (Welch is head of the oncologic imaging research program at the Siteman Cancer Center of Washington University School of Medicine and Barnes-Jewish Hospital and has worked on imaging agents and techniques for many years.)
During irradiation, thermal images of the mice were made with an infrared camera. As is true of cells in other animals that automatically regulate their body temperature, mouse cells function optimally only if the mouse's body temperature remains between 36.5 and 37.5 degrees Celsius (98 to 101 degrees Fahrenheit).
At temperatures above 42 degrees Celsius (107 degrees Fahrenheit) the cells begin to die as the proteins whose proper functioning maintains them begin to unfold.
In the nanocage-injected mice, the skin surface temperature increased rapidly from 32 degrees Celsius to 54 degrees C (129 degrees F).
In the buffer-injected mice, cependant, the surface temperature remained below 37 degrees Celsius (98.6 degrees Fahrenheit).
To see what effect this heating had on the tumors, the mice were injected with a radioactive tracer incorporated in a molecule similar to glucose, the main energy source in the body. Positron emission and computerized tomography (PET and CT) scans were used to record the concentration of the glucose lookalike in body tissues; the higher the glucose uptake, the greater the metabolic activity.
The tumors of nanocage-injected mice were significantly fainter on the PET scans than those of buffer-injected mice, indicating that many tumor cells were no longer functioning.
The tumors in the nanocage-treated mice were later found to have marked histological signs of cellular damage.
Ciblage actif
The scientists have just received a five-year, $2, 129, 873 grant from the National Cancer Institute to continue their work with photothermal therapy.
Despite their results, Xia is dissatisfied with passive targeting. Although the tumors took up enough gold nanocages to give them a black cast, only 6 percent of the injected particles accumulated at the tumor site.
Xia would like that number to be closer to 40 percent so that fewer particles would have to be injected. He plans to attach tailor-made ligands to the nanocages that recognize and lock onto receptors on the surface of the tumor cells.
In addition to designing nanocages that actively target the tumor cells, the team is considering loading the hollow particles with a cancer-fighting drug, so that the tumor would be attacked on two fronts.
But the important achievement, from the point of view of cancer patients, is that any nanocage treatment would be narrowly targeted and thus avoid the side effects patients dread.
The TV and radio character the Lone Ranger used only silver bullets, allegedly to remind himself that life was precious and not to be lightly thrown away. If he still rode today, he might consider swapping silver for gold.