La matière est disponible en différentes tailles, formes et couleurs. Considérez le chlore, un gaz jaunâtre ou le plomb, un solide gris-noir ou le mercure, un liquide argenté. Trois éléments très différents, chaque matériau étant composé d'un seul type d'atome. Les différences dans la matière se résument aux plus petites différences dans la structure atomique.
TL; DR (Trop long; n'a pas lu)
Comprenez que les isotopes d'un élément ont des nombres de masse différents mais le même nombre de protons. À l'aide du tableau périodique, recherchez le numéro atomique de l'élément. Le numéro atomique est égal au nombre de protons. Dans un atome équilibré, le nombre d'électrons est égal au nombre de protons. Dans un atome déséquilibré, le nombre d'électrons est égal au nombre de protons plus l'opposé de la charge ionique. Calculez le nombre de neutrons en soustrayant le numéro atomique du nombre de masse. Si le nombre de masse d'un isotope spécifique n'est pas connu, utilisez la masse atomique du tableau périodique, arrondie au nombre entier le plus proche, moins le nombre atomique pour trouver le nombre moyen de neutrons pour l'élément.
Structure des atomes
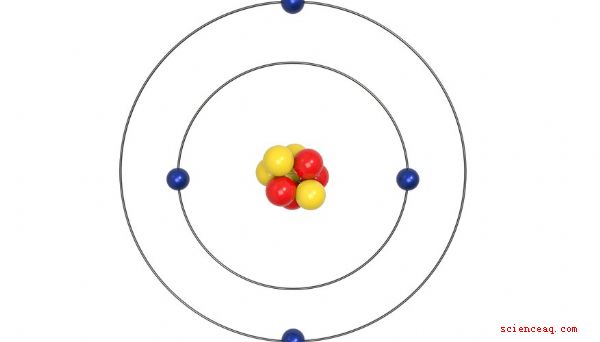
Trois particules principales forment chaque atome. Les protons et les neutrons se regroupent dans le noyau au centre de l'atome. Les électrons forment un nuage tournant autour du noyau. Les protons et les neutrons constituent la masse des atomes. Les électrons, minuscules par rapport aux protons et aux neutrons, contribuent très peu à la masse globale des atomes.
Atomes et isotopes
Les atomes du même élément ont le même nombre de protons. Tous les atomes de cuivre ont 29 protons. Tous les atomes d'hélium ont 2 protons. Les isotopes se produisent lorsque les atomes d'un même élément ont des masses différentes. Étant donné que le nombre de protons d'un élément ne change pas, la différence de masse se produit en raison du nombre différent de neutrons. Le cuivre, par exemple, a deux isotopes, le cuivre-63 et le cuivre-65. Le cuivre 63 a 29 protons et un nombre de masse de 63. Le cuivre 65 a 29 protons et un nombre de masse 65. L'hélium a 2 protons et a presque toujours un nombre de masse de 4. Très rarement, l'hélium forme l'isotope hélium 3, qui a toujours 2 protons mais a un nombre de masse de 3.
Une méthode d'écriture de la formule d'un isotope montre le nom ou le symbole de l'élément suivi du nombre de masse, comme l'hélium-4 ou He-4. Une autre identification abrégée des isotopes montre le nombre de masse en exposant et le numéro atomique en indice, tous deux indiqués avant le symbole atomique. Par exemple, 4 2He indique l'isotope de l'hélium avec le nombre de masse 4. L'agencement du tableau périodique des éléments fournit des informations essentielles pour trouver le nombre de protons , neutrons et électrons dans les atomes. Le tableau périodique moderne met les éléments en ordre de leurs protons. Le premier élément sur la table, l'hydrogène, a un proton. Le dernier élément (au moins pour l'instant) sur la table, Oganesson ou Ununoctium, a 118 protons. Le numéro atomique sur le tableau périodique identifie le nombre de protons dans n'importe quel atome de cet élément. Le cuivre, numéro atomique 29, possède 29 protons. Trouver le numéro atomique d'un élément révèle le nombre de protons. La différence entre les isotopes d'un élément dépend du nombre de neutrons. Pour trouver le nombre de neutrons dans un isotope, trouvez le nombre de masse de l'isotope et le numéro atomique. Le numéro atomique, ou nombre de protons, se trouve sur le tableau périodique. La masse atomique, également trouvée sur le tableau périodique, est la moyenne pondérée de tous les isotopes de l'élément. Si aucun isotope n'est identifié, la masse atomique peut être arrondie au nombre entier le plus proche et utilisée pour trouver le nombre moyen de neutrons. Par exemple, la masse atomique du mercure est de 200,592. Mercure a plusieurs isotopes dont le nombre de masse varie de 196 à 204. En utilisant la masse atomique moyenne, calculez le nombre moyen de neutrons en arrondissant d'abord la masse atomique de 200,592 à 201. Maintenant, soustrayez le nombre de protons, 80, de la masse atomique , 201-80, pour trouver le nombre moyen de neutrons, 121. Si le nombre de masse d'un isotope est connu, le nombre réel de neutrons peut être calculé. Utilisez la même formule, le nombre de masse moins le numéro atomique, pour calculer le nombre de neutrons. Dans le cas du mercure, l'isotope le plus courant est le mercure-202. Utilisez l'équation 202-80 \u003d 122 pour trouver que le mercure 202 contient 122 neutrons. Un isotope neutre n'a pas de charge, ce qui signifie que les charges positives et négatives s'équilibrent dans un isotope neutre. Dans un isotope neutre, le nombre d'électrons est égal au nombre de protons. Comme pour trouver le nombre de protons, trouver le nombre d'électrons dans un isotope neutre nécessite de trouver le numéro atomique de l'élément. Dans un ion, un isotope avec une charge positive ou négative, le nombre de protons ne fait pas '' "t equal the number of electrons.", 3, [[Si les protons sont plus nombreux que les électrons, l'isotope a plus de charges positives que de charges négatives. En d'autres termes, le nombre de protons dépasse le nombre d'électrons du même nombre que la charge positive. Si le nombre d'électrons dépasse le nombre de protons, la charge ionique sera négative. Pour trouver le nombre d'électrons, ajoutez l'opposé du déséquilibre de charge au nombre de protons. Par exemple, si un isotope a une charge de -3, comme avec le phosphore (numéro atomique 15), alors le nombre d'électrons est trois de plus que le nombre de protons. Le calcul du nombre d'électrons devient alors 15 + (- 1) (- 3) ou 15 + 3 \u003d 18, ou 18 électrons. Si un isotope a une charge +2, comme avec le strontium (numéro atomique 38), alors le nombre d'électrons est deux de moins que le nombre de protons. Dans ce cas, le calcul devient 38 + (- 1) (+ 2) \u003d 38-2 \u003d 36, donc l'ion a 36 électrons. Le raccourci habituel pour les ions montre le déséquilibre de charge en exposant suivant le symbole atomique. Dans l'exemple du phosphore, l'ion serait écrit P -3.
Tableau périodique des éléments
Combien de protons?
Combien de neutrons?
Combien d'électrons?