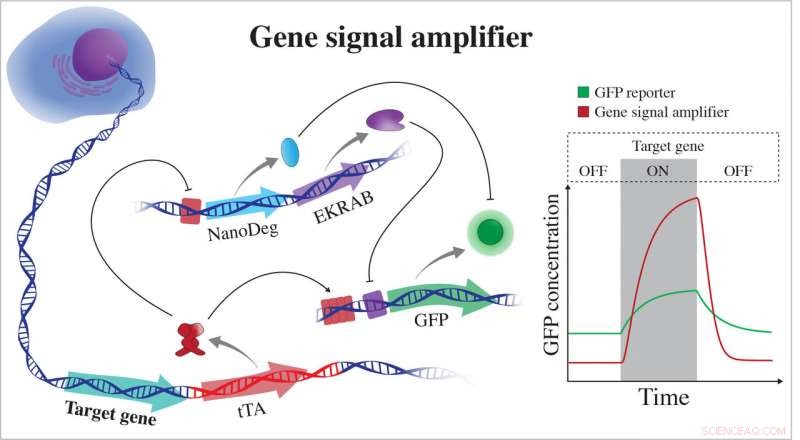
L'amplificateur de signal génique développé par les bioscientifiques de l'Université Rice excelle dans la détection de l'expression des gènes cibles et peut également être utilisé pour détecter potentiellement n'importe quel gène cellulaire. L'amplificateur est lié au chromosome d'une cellule et rend compte directement de l'activité d'un gène en exprimant des protéines fluorescentes (GFP). Lorsque le gène n'est pas actif, l'amplificateur exprime des régulateurs négatifs qui éteignent la GFP en opérant à différents niveaux hiérarchiques du flux d'informations cellulaires. EKRAB est un répresseur transcriptionnel et NanoDeg est un régulateur post-traductionnel. Lorsque le gène est actif, Le tTA produit de la GFP et bloque l'expression des régulateurs négatifs. Crédit :Segatori Research Group/Rice University
Un nouveau système pour amplifier les signaux d'expression génique pourrait changer la donne pour les scientifiques qui étudient les processus de régulation dans les cellules qui sont au cœur de toute vie.
Le laboratoire de bioscientifique Laura Segatori de l'Université Rice a développé un amplificateur de signal génétique polyvalent qui peut mieux détecter l'expression des gènes cibles que les méthodes actuelles.
Finalement, les chercheurs espèrent que le système à deux modules simplifiera le diagnostic de maladies comme la maladie d'Alzheimer, diabète et certains cancers caractérisés par des schémas distincts d'expression des protéines. Ils ont déclaré que cela pourrait également permettre des thérapies cellulaires grâce auxquelles les cellules malades pourraient fabriquer leur propre médicament au moment où elles en ont besoin.
Leur travail est décrit dans Nature Chimie Biologie .
Le premier module fait partie d'une chaîne de code génétique synthétique ajouté à l'ADN d'une cellule de mammifère via l'édition CRISPR-Cas9. Une fois intégré adjacent à un gène cible, le code active un circuit génétique qui surveille le gène et, chaque fois que le gène produit une protéine, le circuit émet également une protéine fluorescente verte (GFP). Le circuit est conçu pour amplifier le signal GFP et permettre la détection de très petits changements dans le gène cible qui ne sont pas toujours possibles avec les outils actuels.
Lorsque le gène est inactif, le deuxième module basé sur un anticorps trouvé pour la première fois chez les chameaux arrête la production de la protéine fluorescente et dégrade les GFP à proximité. La combinaison donne aux chercheurs un signal "on-off" fort qui est également sensible à la dynamique d'expression du gène cible. Lorsque l'expression des gènes augmente, le circuit active l'expression de la GFP et inhibe en même temps l'expression des régulateurs négatifs de la GFP, comme le nanocorps.
"Être capable de surveiller l'expression des gènes avec une sensibilité élevée est vraiment important pour une variété d'applications biomédicales, " Segatori a déclaré. " Il est important d'avoir un système de détection qui est sensible à même de petits changements dans l'expression des gènes, qui sont souvent biologiquement pertinents. Il est également essentiel pour un système de détection qui offre une bonne résolution dynamique afin que nous puissions suivre la dynamique d'expression des gènes, qui sont généralement un déterminant clé du comportement cellulaire.
"C'est ce que fait essentiellement notre amplificateur de signal génétique, " dit-elle. " Nous avons développé un circuit génétique qui, d'abord, nous pouvons nous lier à n'importe quel gène du chromosome, générant ainsi un outil qui récapitule le contexte chromosomique avec toute la complexité de régulation associée. Nous n'avons aucun type de rapporteurs extrachromosomiques. Cette approche offre un moyen sensible de surveiller tous les mécanismes régulateurs et épigénétiques qui régulent l'expression des gènes.
"Ensuite, nous avons développé une méthode pour amplifier le signal afin que nous puissions surveiller de très petits changements d'expression, " dit-elle. " Il est très robuste et stable et a une résolution dynamique élevée. "
Le système peut être adapté pour surveiller potentiellement n'importe quel gène cellulaire, dit Segatori. « Nous pouvons créer des systèmes de rapporteurs multiplex pour surveiller un groupe de gènes qui sont pertinents pour le développement d'une certaine maladie ou qui fournissent une lecture complète d'une certaine voie de signalisation ou d'un phénotype, " elle a dit.
L'équipe a démontré la méthode sur une variété de cellules et généré un rapporteur multiplex pour surveiller les marqueurs associés à trois voies de signalisation qui répondent au stress dans le réticulum endoplasmique d'une cellule de mammifère. Ils ont découvert que le circuit améliorait suffisamment le signal fluorescent pour détecter même de petits changements d'expression.
Le deuxième module, un circuit NanoDeg introduit par le laboratoire Rice en 2017, est un contrôle post-traduction qui donne au système sa large plage dynamique, dit Segatori. « Dans des conditions basales, le circuit exprime non seulement un régulateur transcriptionnel qui inhibe l'expression de la GFP mais également des molécules NanoDeg qui dégradent toute GFP présente dans le système, donc la cellule devient complètement sombre, " dit-elle. " Et nous pouvons régler le système pour l'adapter à la détection de gènes avec une expression basale différente en utilisant des doses appropriées d'inducteurs des composants du circuit. "
Les expériences ont confirmé que l'intégration du système dans le chromosome de la cellule n'affecte pas l'expression des gènes cibles.
Dans le cadre de l'étude, le laboratoire a également développé un modèle mathématique que les chercheurs peuvent utiliser pour personnaliser la plate-forme d'amplification afin de surveiller tout gène cible et de prédire les doses optimales d'inducteurs à petites molécules utilisés pour réguler l'expression des gènes.
Segatori et son équipe travaillent à l'amélioration de la plateforme, principalement développé par l'étudiant diplômé de Rice et auteur principal Carlos Origel Marmolejo, pour traiter la maladie.
« Il existe actuellement un grand intérêt pour le développement de thérapies cellulaires réactives au feedback, " a déclaré Segatori. " Notre plate-forme pourrait permettre la production de produits thérapeutiques en réponse à la détection de signatures d'expression génique pertinentes pour une certaine maladie ou condition environnementale. "