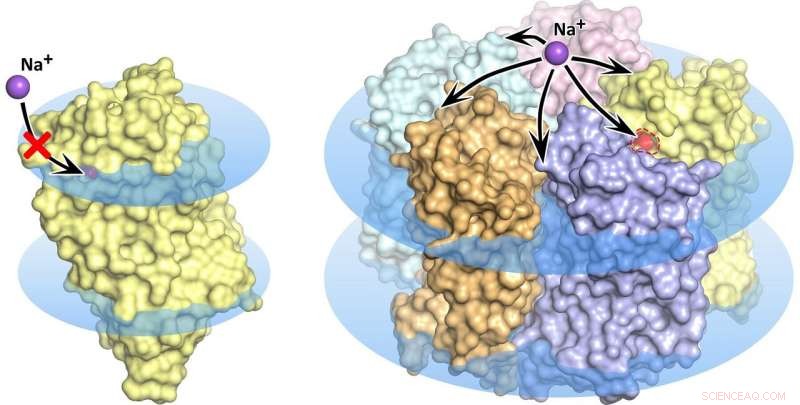
Monomère de rhodopsine KR2 (à gauche) et pentamère (à droite) dans la membrane cellulaire, représentés par des disques bleus. A l'état de monomère, le transport du sodium est bloqué, le pore orange ne permet pas l'absorption d'ions dans la protéine. Crédit :Kirill Kovalev et al./ Avancées scientifiques
Une équipe de biophysiciens de Russie, Allemagne, et française, avec des chercheurs de l'Institut de physique et de technologie de Moscou, a découvert et étudié la structure de la rhodopsine KR2 dans des conditions physiologiques. Ce travail pionnier ouvre la voie à une future percée en optogénétique, un domaine très pertinent de la biomédecine avec des applications dans le traitement des maladies neurologiques et plus encore. La découverte fondamentale conduira à un nouvel instrument pour une thérapie efficace de la dépression, troubles anxieux, épilepsie, et la maladie de Parkinson. Le document faisant état de l'étude a été publié dans Avancées scientifiques .
L'optogénétique est un domaine entièrement nouveau de la biophysique et de la biomédecine explorant les techniques permettant de contrôler les cellules nerveuses et musculaires d'un organisme vivant via des signaux lumineux. Il n'y a pas longtemps, la principale revue de recherche Science a salué l'optogénétique comme la « percée de la décennie ». Les méthodes optogénétiques permettent déjà une récupération partielle de la vue perdue, audience, et le contrôle musculaire altéré par une maladie neurologique. Surtout, ces techniques permettent aux chercheurs d'étudier en détail les réseaux de neurones. Il ne s'agit pas des réseaux informatiques mais de ceux logés dans le cerveau humain et responsables de nos émotions, la prise de décision, et d'autres processus fondamentaux.
Il y a plusieurs années, les chercheurs ont découvert un nouveau type de transporteur d'ions, la rhodopsine KR2, dans la membrane cellulaire de la bactérie marine Krokinobacter eikastus. La protéine nouvellement trouvée est sensible à la lumière, ce qui le rend utile pour l'optogénétique. Poussé par la lumière, de telles protéines peuvent faciliter la translocation de particules chargées telles que des ions à travers la membrane cellulaire. En introduisant de tels transporteurs dans la cellule, les chercheurs peuvent ensuite utiliser des impulsions lumineuses pour manipuler le potentiel de la membrane cellulaire des neurones, contrôler son activité. Il a été démontré que KR2 transportait sélectivement un type particulier de particules, les ions sodium, à l'extérieur de la cellule. Plutôt que de permettre le passage de ces ions dans les deux sens, la protéine effectue un transport actif, servant de "pompe". Les formes mutantes de KR2 ont également montré une activité de pompage de potassium. En implantant ces pompes dans la membrane cellulaire, l'ensemble de l'activité des neurones pourrait théoriquement être contrôlé.
La vague de recherche qui a suivi la découverte de la nouvelle pompe moléculaire s'est heurtée à des propriétés assez mystérieuses de la rhodopsine. Plusieurs groupes de recherche ont découvert et décrit un total de cinq structures différentes de la protéine prometteuse. Notamment, dans certaines de ces structures cinq molécules KR2 forment un pentamère stable, tandis que dans d'autres, seul le monomère protéique est présent (figure 1).
« Donc, la question dramatique était :laquelle de ces structures devrait être considérée comme la bonne ? » a déclaré Kirill Kovalev, doctorant au MIPT, un auteur principal de l'étude. "En réalité, les structures se sont avérées assez similaires, mais le diable est dans les détails, qui déterminent les applications possibles de la protéine en science et en pratique clinique."
Dirigé par les biophysiciens du MIPT, l'équipe a découvert ce qui donne lieu à la variété déroutante des structures protéiques. Il s'est avéré que les groupes de recherche étudiant KR2 avaient cristallisé la protéine dans différentes conditions. La protéine unique est à l'origine produite par une bactérie océanique originaire d'un environnement très spécial. Il vit dans une eau avec une salinité spécifique, acidité, et la concentration en ions hydrogène (pH). Ces conditions sont une condition préalable pour que la protéine fasse ce que les chercheurs attendent d'elle, c'est-à-dire pomper les ions sodium, tout en formant également des pentamères dans la membrane cellulaire. Les nombreuses "fausses" structures de la protéine se sont avérées être des artefacts de cristallisation ou ne correspondent qu'aux conditions qui désactivent virtuellement l'activité de pompage de sodium de KR2, ce qui le rend très attrayant pour la communauté mondiale de l'optogénétique.
"Pour la première fois, nous avons simulé les conditions physiologiques d'existence et de fonctionnement de KR2. Par conséquent, nous avons obtenu la structure « correcte » de la nouvelle protéine, qui correspond à son état natif. Nous avons montré que l'unité fonctionnelle de la protéine est un pentamère, " explique Valentin Gordeliy de l'Institut de biologie structurale de Grenoble. " De plus, nous avons trouvé une explication aux contradictions entre les études structurelles précédentes de la protéine. »
La rhodopsine KR2 est révolutionnaire pour l'optogénétique, et connaître sa structure correcte dans des conditions physiologiques est fondamental à la fois pour comprendre les mécanismes de son fonctionnement et pour explorer le système nerveux en modélisant de nouveaux outils optogénétiques et en les appliquant à la pratique médicale.