Crédit :Wiley
Les taux de conversion incroyablement élevés des enzymes naturelles résultent en partie de l'augmentation de l'activité catalytique de quelques chaînes latérales d'acides aminés sélectionnées grâce à un positionnement précis dans la cavité de liaison aux protéines. Les scientifiques ont maintenant démontré qu'un tel réglage est également possible pour les enzymes « conceptrices » avec des acides aminés catalytiques non naturels. Dans la revue Angewandte Chemie , ils rapportent que "l'évolution" en laboratoire d'une enzyme de conception avec une chaîne latérale d'aniline a conduit à des variantes avec une activité significativement plus élevée.
La vitesse et la sélectivité avec lesquelles les enzymes dans la nature catalysent les conversions sont enviables. Pour stimuler catalytiquement les réactions non naturelles, les chercheurs imitent les enzymes à l'aide de structures protéiques réalisées par conception de protéines assistée par ordinateur. Une optimisation supplémentaire est obtenue par la répétition d'un cycle darwinien :1) diversification par mutation, 2) identification de catalyseurs améliorés, et 3) l'amplification des variants enzymatiques les plus efficaces. Cela permet la production d'enzymes de conception avec des activités très élevées.
Des chercheurs dirigés par Clemens Mayer et Gerard Roelfes à l'Université de Groningen (Pays-Bas) ont maintenant démontré que ce type d'évolution dirigée est également une méthode pour améliorer l'efficacité d'une nouvelle classe d'enzymes de conception :les enzymes qui contiennent un acide aminé qui est pas utilisé par la nature.
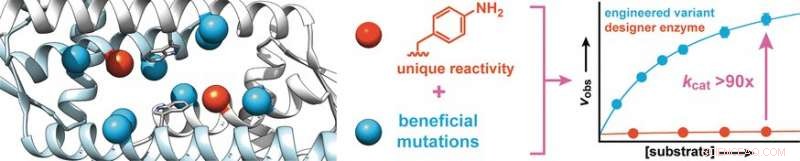
A partir d'une protéine de Lactococcus lactis, une bactérie utilisée dans la fabrication de produits laitiers tels que le fromage et le babeurre, les chercheurs ont synthétisé une enzyme de conception qui contient un acide aminé avec une chaîne latérale d'aniline abiotique (aminophénylalanine). Comme l'aniline libre, cet acide aminé catalyse la réaction d'aldéhydes avec des hydrazines ou des hydroxylamines pour faire des hydrazones ou des oximes, respectivement.
Pour augmenter l'activité de l'enzyme, les chercheurs ont produit des variantes enzymatiques avec des mutations au niveau des acides aminés proches de la chaîne latérale de l'aniline. Le criblage d'environ 400 mutants a donné deux candidats avec une meilleure activité, dont l'un a été soumis à un second cycle évolutif. Cela a conduit à la découverte de mutations plus bénéfiques. Pour identifier les effets synergiques, plusieurs mutations favorables ont été combinées pour produire d'autres variantes. De cette façon, il a été possible d'augmenter le taux de conversion de l'enzyme d'un facteur 90.
Les chercheurs soulignent que, apparenté aux enzymes naturelles, "cette augmentation drastique est basée sur le renforcement de l'activité catalytique inhérente de la chaîne latérale de l'aniline. Nous avons l'intention d'utiliser ce principe pour incorporer d'autres catalyseurs organiques en tant que chaînes latérales dans les enzymes, et d'utiliser l'évolution dirigée pour les convertir en enzymes de conception hautement efficaces qui peuvent effectuer rapidement et efficacement des réactions synthétiquement importantes qui, autrement, ne se dérouleraient que très lentement. »