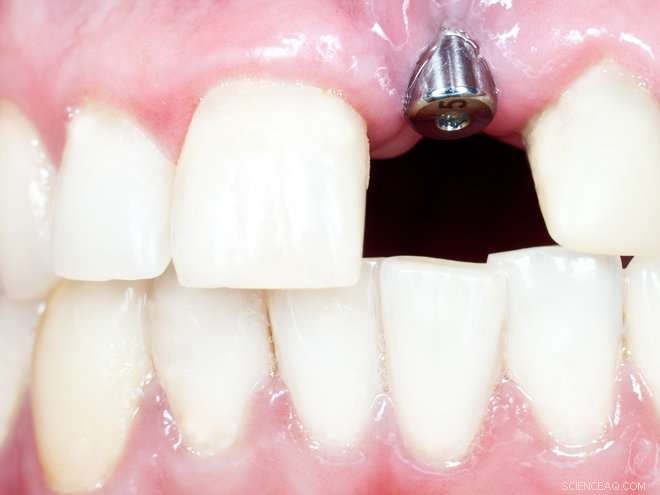
Les implants dentaires sont de plus en plus courants comme substituts des dents en Norvège. Le remplacement ne se fait pas toujours sans problème, toutefois. Crédit :Colourbox.com
Les molécules qui sont plus souvent connues pour leur potentiel cancérigène peuvent avoir un nouveau rôle de promotion de la santé. Les scientifiques découvrent maintenant comment ces "radicaux" peuvent être utilisés pour prévenir les infections et favoriser le succès à long terme des implants dentaires.
Bien que les dentistes recommandent de garder nos propres dents le plus longtemps possible, de plus en plus d'entre nous auront éventuellement besoin d'une ou plusieurs dents remplacées par des implants en titane. Cela est particulièrement vrai pour les générations plus âgées.
Cependant, les implants dentaires s'avèrent souvent n'être qu'un remplacement partiellement réussi. Les bactéries peuvent coloniser la zone autour d'un implant. Les infections bactériennes autour d'un implant peuvent finalement conduire à une perte de l'os supportant l'implant, laissant le patient dans un grand besoin de traitement intensif et en conséquence une santé bucco-dentaire plus mauvaise.
Si l'os autour d'un implant est infecté, il existe un risque sérieux que le patient ait besoin d'un traitement dentaire restaurateur complet et d'un entretien afin de maintenir la fonction de l'implant et de restaurer l'os perdu, si possible du tout. Par conséquent, la recherche sur les biomatériaux pouvant être utilisés pour augmenter et guider la repousse de l'os perdu est devenue un domaine de pointe de la recherche dentaire.
Biofilms sur implants
Pour qu'un implant dentaire fonctionne, il doit être solidement attaché à la mâchoire. Cela signifie que les cellules osseuses doivent battre les bactéries dans ce qu'on appelle la « course à la surface » de l'implant. En remportant la course, les cellules osseuses formeront un nouveau tissu osseux autour de l'implant, fixation de l'implant dans l'os.
Cependant, ce sont souvent les bactéries qui gagnent la course. Ils forment un biofilm, une fine couche de bactéries sur la surface de l'implant. – Le biofilm est un moyen intelligent pour les bactéries de coloniser les surfaces; il rend les bactéries plus fortes, explique David Wiedmer, chercheur à la Faculté de médecine dentaire de l'Université d'Oslo. Si les bactéries prennent le dessus sur la surface de l'implant, l'implant est sujet aux infections, avec des conséquences potentiellement graves pour la santé du patient.
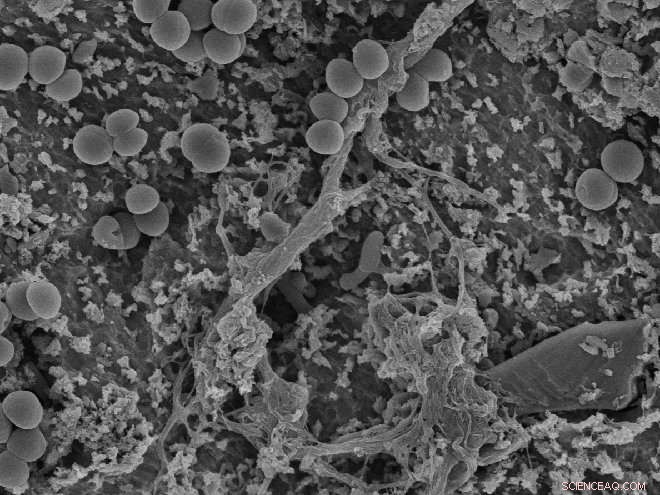
Les bactéries ont gagné la course à la conquête de la surface :les « points » circulaires sont des bactéries qui se sont attachées à la surface d'un implant. Les essais de Wiedmer ont montré que les molécules radicalaires peuvent contribuer à perturber les bactéries et provoquer un effet antibactérien. Crédit :OD, Interface utilisateur/David Wiedmer
Les implants infectés sont généralement traités avec des antibiotiques. – Lorsque les bactéries forment un biofilm, les antibiotiques ne font souvent pas le travail parce que les bactéries sont protégées dans un biofilm. Compte tenu de l'augmentation spectaculaire des bactéries résistantes aux antibiotiques, il y a un besoin urgent de trouver des traitements alternatifs, dit Wiedmer, qui est à l'origine un ingénieur en mécanique. Il a commencé à considérer les radicaux libres comme une alternative. Ces molécules instables peuvent provoquer un stress chez les bactéries, qui à son tour peut créer un effet antibactérien.
Molécules radicalaires hautement réactives
Les radicaux libres sont des molécules instables car ils ont un électron non apparié. Ainsi, ils sont toujours à la recherche d'un autre électron avec lequel s'apparier. Les radicaux libres sont connus pour être des molécules nocives et pathogènes qui peuvent provoquer des changements dans l'ADN, ce qui à son tour peut créer des mutations pouvant conduire au cancer. L'hypothèse de Wiedmer était que la réactivité des radicaux libres pourrait également être utilisée pour tuer les bactéries.
Il a basé son idée sur un processus chimique connu, photocatalyse :lorsque le dioxyde de titane (TiO2) est exposé à la lumière ultraviolette, comme on le trouve au soleil, en présence d'oxygène, la surface se nettoie de toute saleté organique, le décomposer en eau et en oxygène. Ce processus de nettoyage est basé sur la formation de radicaux libres et c'est la même réaction qui est utilisée dans les cellules solaires pour produire de l'énergie.
Les implants dentaires ont également du TiO2 à leur surface. Presque tous les implants dentaires sont en titane, et TiO2 est créé lorsque le titane entre en contact avec l'oxygène de l'air ou du sang, par exemple. lorsqu'un implant est inséré dans la bouche.
Catalyse noire pour le traitement et la prévention
Cependant, il est difficile de produire des réactions photocatalytiques sur implants. Cela est dû au problème évident d'ajouter la lumière solaire nécessaire dans la réaction entre le TiO2 sur la surface de l'implant et l'oxygène dans le sang lorsque l'implant est déjà inséré dans l'os de votre mâchoire.

En étudiant à quelle vitesse la solution chimique a perdu sa couleur bleue, Le candidat au doctorat David Wiedmer a pu détecter quels types de dioxyde de titane (TiO2) ont contribué à ce que les bactéries n'établissent pas de biofilm sur les implants. Crédit :OD, UiO/Margit Selsjord
Pour cette raison, Wiedmer a étudié le traitement des infections bactériennes sur implants à l'aide d'une méthode qu'il appelle « catalyse noire ». En combinant TiO et peroxyde d'hydrogène (H2O2), au lieu de l'eau et du soleil, il obtient un effet similaire à celui de la photocatalyse. Lorsque H2O2 est ajouté sur un implant recouvert d'une couche de TiO2, des radicaux libres sont également libérés, mais cette fois dans le noir.
Compte tenu des fortes propriétés antibactériennes des radicaux libres produits, Wiedmer a étudié la catalyse noire sur TiO2 dans deux applications biomédicales différentes. La première application testée était de traiter une infection existante autour d'un implant. Ses recherches ont également examiné si la méthode pouvait avoir un effet préventif sur les "échafaudages", des cadres poreux qui peuvent être insérés dans l'os de la mâchoire pour soutenir et guider les cellules osseuses afin qu'elles se développent et forment un « nouvel » os.
Prometteur, mais difficile a mettre en oeuvre
Wiedmer a des raisons d'être optimiste sur le fait qu'il sera un jour possible de contrôler les infections bactériennes autour des implants dentaires et de les prévenir plus facilement. Ses études ont montré que la catalyse noire est une méthode prometteuse pour traiter les infections car elle crée des radicaux qui aident à combattre les bactéries.
La recherche a également indiqué que la catalyse sombre pourrait être davantage développée et appliquée aux échafaudages osseux. Ces échafaudages soutiennent la régénération du tissu osseux perdu dans lequel les implants peuvent ensuite être insérés. Dans ses études, Wiedmer a découvert que les radicaux formés par catalyse sombre pouvaient empêcher les bactéries de coloniser la surface des échafaudages poreux en TiO2.
"L'effet préventif est en fait plus important que leur utilisation dans le traitement d'infections préexistantes. Après tout, les implants qui causent des problèmes dus aux infections peuvent, en dernier recours, être extrait. Mais vous ne pouvez pas facilement retirer un échafaudage poreux une fois que l'os a déjà poussé dans les pores de l'échafaudage, " il explique.
Cependant, il y a beaucoup plus de recherches à faire avant que la catalyse sombre puisse être appliquée en chirurgie dentaire. Wiedmer n'a pas pu exclure de manière concluante la possibilité que les radicaux puissent également endommager l'ADN cellulaire tout en combattant les bactéries. – J'espère que cette nouvelle stratégie d'utilisation des radicaux libres pour tuer les bactéries pourra nous aider à trouver des traitements alternatifs aux antibiotiques. Même s'il reste encore du chemin à parcourir, y compris les essais cliniques, ce projet pourrait éventuellement jeter un peu plus de lumière dans l'obscurité, Wiedmer dit avec un sourire.