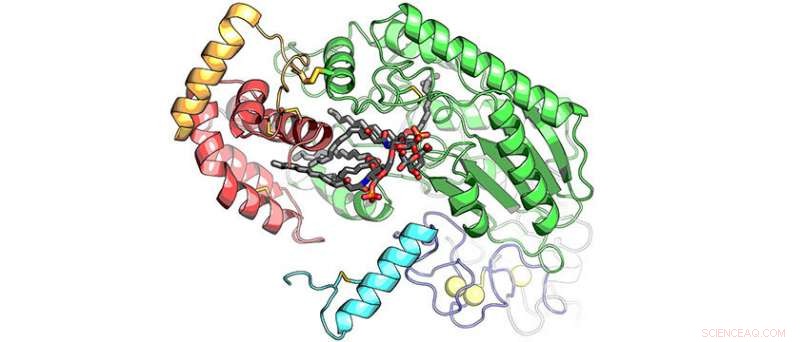
Structure cristalline de l'enzyme hôte, Acyloxyacyl hydrolase (AOAH), en complexe avec lipopolysaccharide (LPS) représenté en bâtonnets gris, qui est une toxine bactérienne puissante. La figure montre l'une des six chaînes d'acides gras du LPS balancée et positionnée dans le site actif de l'AOAH prête à être coupée, rendant le LPS immunologiquement inerte. Cette fonction enzymatique de l'AOAH est cruciale pour récupérer de la tolérance immunitaire qui suit généralement une infection bactérienne à Gram négatif. Crédit :Bhushan Nagar
Les biochimistes de l'Université McGill se penchent sur la façon dont une enzyme spécifique qui fait partie du système immunitaire humain interagit avec un certain groupe de bactéries décrites comme gram-négatives.
Des chercheurs du monde entier « ont étudié l'enzyme, connu sous le nom d'AOAH, depuis plus de 30 ans. C'est la première fois que quelqu'un peut voir exactement à quoi cela ressemble, " selon Bhushan Nagar, professeur agrégé de biochimie à l'Université McGill à Montréal.
Plus que ça, les images 3D ont capturé un moment dans le temps qui montre à quel point l'AOAH inactive une molécule toxique qui fait généralement partie de diverses bactéries gram-négatives. La recherche a été menée à la Canadian Light Source.
De nombreux types de bactéries gram-négatives existent dans l'environnement. Alors que certains sont inoffensifs, beaucoup causent diverses maladies humaines, dit Nagar. Par exemple, plusieurs espèces comme E. coli et Salmonella, provoquer des maladies d'origine alimentaire. D'autres provoquent des infections telles que la pneumonie, méningite, infections du sang ou gonorrhée.
Certains types d'infections bactériennes à Gram négatif présentent une résistance aux médicaments et sont de plus en plus difficiles à traiter, il est donc encore plus important de comprendre comment le système immunitaire humain interagit avec eux.
Lorsqu'une infection se développe, il déclenche généralement une inflammation par l'intermédiaire d'un composant toxique de l'enveloppe externe des bactéries gram-négatives, appelé lipopolysaccharide (LPS) – également communément appelé endotoxine.
"L'inflammation est une réponse protectrice du système immunitaire lors de la lutte contre les infections, " dit Nagar.
C'est ce qui cause la fièvre, douleurs, gonflement et parfois rougeur sur la peau. Mais il y a un bel équilibre. Trop d'inflammation peut rendre une personne plus malade et même mourir, alors que trop peu n'aidera pas à tuer les bactéries causant l'infection. Le système immunitaire contrôle ce problème en atténuant l'inflammation après la réponse aiguë initiale. De cette façon, l'inflammation ne cause pas de dommages excessifs.
Une fois l'infection éliminée, le système doit se réinitialiser pour être prêt à combattre de nouvelles infections. Ce travail tombe entre les mains de l'enzyme AOAH. Avec la bactérie à Gram négatif, il a été constaté que les cibles AOAH, lier à, et supprime deux régions spécifiques sur LPS, le rendant inefficace et provoquant la réinitialisation du système.
Les chercheurs ont pu voir les images en utilisant un échantillon cristallisé d'AOAH lié à une partie du LPS. Les résultats ont permis d'examiner en détail la structure moléculaire de l'AOAH et ont clairement montré quelles parties de sa surface interagissaient avec la toxine.
"Nous pourrions en fait voir le mécanisme moléculaire que l'enzyme utilise pour couper des parties du LPS pour l'inactiver, " dit Nagar.
Les résultats ont été publiés dans le Actes de l'Académie nationale des sciences plus tôt cette année.
Les images fournissent une carte de l'enzyme AOAH et ouvrent la porte à d'autres directions de recherche. Certaines formes d'AOAH sont associées à certaines maladies telles que l'asthme et la sinusite chronique. Connaître sa structure complète aidera les chercheurs à mieux comprendre à quoi ressemblent ses variations causant la maladie et pourrait fournir les détails nécessaires pour développer de nouveaux traitements contre les infections ou des approches pour les prévenir.