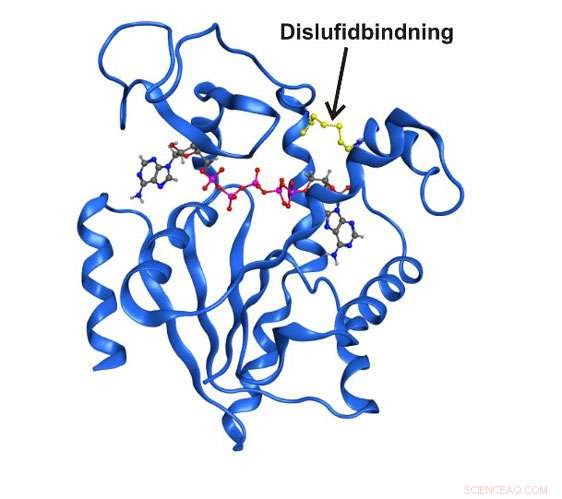
Structure aux rayons X à haute résolution de l'enzyme adénylate kinase piégée dans un état structurel transitoire par une liaison disulfure covalente. Crédit :Université d'Umea
Des chimistes de l'Université d'Umeå ont réussi à cartographier les structures et les fonctions d'un état enzymatique transitoire. En modifiant l'enzyme adénylate kinase, les chercheurs ont pu isoler la molécule et l'étudier à l'aide des techniques quantitatives de cristallographie aux rayons X et de spectroscopie de résonance magnétique nucléaire (RMN). Les résultats ont été publiés dans la revue PNAS .
« Nous avons maintenant fait un pas de plus vers une compréhension générale du fonctionnement des enzymes. Ceci est vital pour les futures conceptions de nouvelles enzymes dans les applications biotechnologiques, " dit Magnus Wolf-Watz, professeur agrégé au Département de chimie de l'Université d'Umeå.
La vie biologique dépend d'un grand nombre de cellules, réactions chimiques qui sont souvent extrêmement lentes et peuvent prendre des mois ou des années. Pour que les échelles de temps chimiques et biologiques correspondent, les réactions chimiques sont accélérées dans les cellules grâce à l'utilisation d'enzymes comme biocatalyseurs efficaces.
Au cours de la dernière décennie de recherche, il a été clairement établi que les structures enzymatiques qui n'existent que brièvement et de manière transitoire peuvent être entièrement essentielles pour la fonction catalytique. Jusque là, il n'a pas été possible d'étudier ces états en détail du simple fait qu'ils sont invisibles aux techniques spectroscopiques traditionnelles. Maintenant, des chercheurs du département de chimie de l'université d'Umeå en Suède ont réussi à capturer un état transitoire central à la fonction de l'enzyme essentielle adénylate kinase. L'état à court terme a été possible d'enrichir en échangeant deux acides aminés dans l'enzyme avec l'acide aminé réactif cystéine.
« C'est la première fois que quelqu'un parvient à étudier directement un état transitoire d'une enzyme à l'aide de techniques spectroscopiques et quantitatives. Avec l'utilisation de nos méthodes, nous avons pu décrire en détail à la fois la structure et la fonction de l'enzyme dans la phase transitoire spécifique, " dit Magnus Wolf-Watz, qui a dirigé l'étude avec le postdoctorant Michael Kovermann, qui occupe maintenant une direction de groupe à l'Université de Constance en Allemagne.
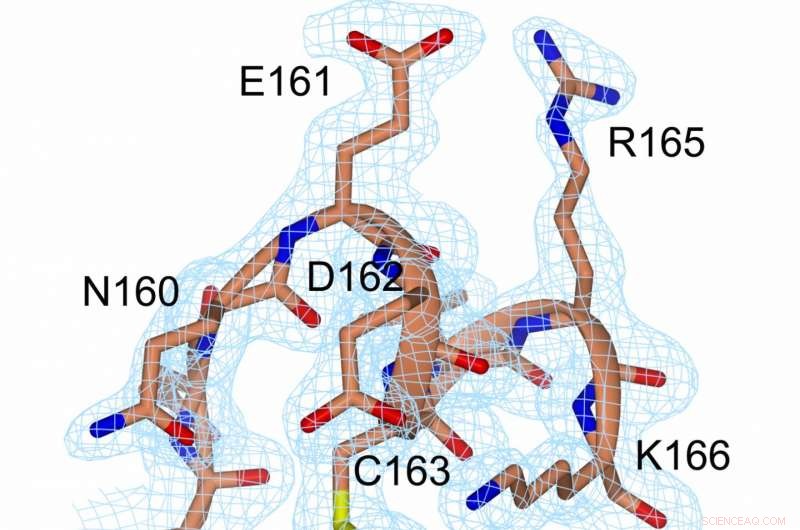
Une représentation de la densité électronique au niveau de la liaison disulfure (jaune, entre C56 et C163) et à proximité immédiate. Crédit :Prof. Michael Kovermann, Université de Constance
Les résultats ont indiqué que la fonction d'une enzyme dépend entièrement de sa dynamique inhérente, et sans dynamique, l'enzyme serait rendue inutile. Par ailleurs, il s'est avéré que l'état transitoire liait ses molécules de substrat beaucoup plus fortement que les protéines naturelles. Les résultats nous ont donné d'autres indices sur la façon dont les enzymes peuvent accélérer les réactions avec une spécificité et une efficacité incroyables. Tout en, la méthode que nous avons développée peut être généralement utile dans les études d'autres enzymes."
L'équipe RMN de Magnus Wolf Watz a collaboré avec les cristallographes aux rayons X Uwe H. Sauer et Elisabeth Sauer-Eriksson sur l'étude.
"Nous avons eu une collaboration à long terme et très productive. C'est un bon exemple de l'importance de l'atmosphère de collaboration qui règne à l'Université d'Umeå, et comment nous devrions le chérir et le développer davantage à l'avenir, " dit Magnus Wolf-Watz.