L'activation excessive des inflammasomes est associée à diverses maladies, notamment la goutte, la maladie d'Alzheimer, l'athérosclérose et le diabète de type 2. Compte tenu du rôle central des macrophages dans l'activation de l'inflammasome et dans la phagocytose des nanoparticules, la découverte de nanoparticules anti-inflammatoires ciblant spécifiquement les macrophages pourrait moduler plus efficacement la réponse inflammatoire tout en minimisant les effets hors cible dans d'autres types de cellules.
Cependant, il a été constaté que la majorité des nanomatériaux actuellement signalés favorisent plutôt qu'inhibent l'activation de l'inflammasome.
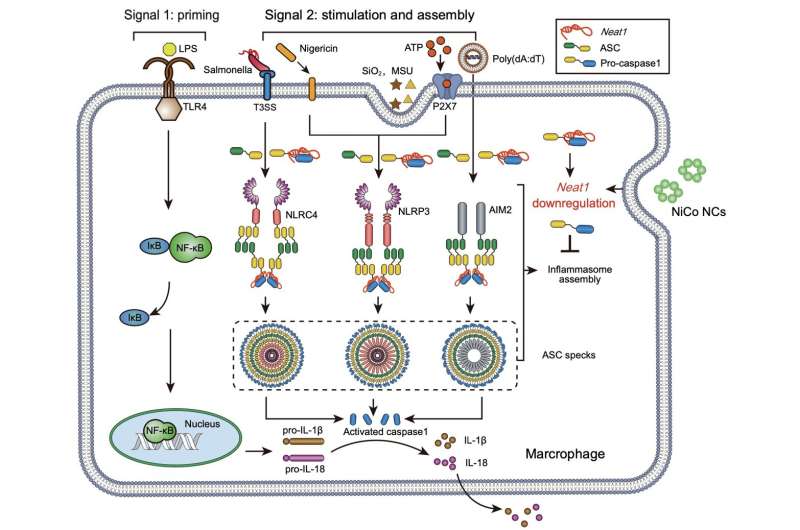
Une étude publiée dans la revue National Science Review ont démontré que les nanocristaux d'alliage nickel-cobalt présentent une efficacité remarquable dans la suppression de l'activation de trois inflammasomes, à savoir NLRP3, NLRC4 et AIM2, dans les macrophages primaires. Par la suite, les chercheurs ont utilisé deux modèles de maladies, la colite et la péritonite aiguë, pour évaluer l'impact des nanocristaux d'alliage nickel-cobalt sur le traitement de la suractivation des inflammasomes.
Les résultats ont révélé que les nanocristaux d'alliage nickel-cobalt atténuaient efficacement les symptômes de la maladie chez les souris dans le modèle de colite, notamment en atténuant la perte de poids, en restaurant la longueur du côlon et en atténuant les dommages causés à l'épithélium de la muqueuse intestinale. De plus, dans le modèle de péritonite aiguë, ces nanocristaux ont atténué de manière significative la chimiotaxie des neutrophiles dans la cavité péritonéale des souris.
Pour confirmer si les nanocristaux d'alliage nickel-cobalt nécessitent une internalisation cellulaire pour exercer leurs effets anti-inflammatoires, les auteurs ont réalisé des expériences en utilisant un inhibiteur d'endocytose largement utilisé, la cytochalasine D. Le traitement à la cytochalasine D a réduit de manière significative l'internalisation des nanocristaux d'alliage nickel-cobalt par les macrophages.
De plus, l'inhibition de l'internalisation des nanocristaux par les macrophages a entraîné une diminution de leurs effets anti-inflammatoires, indiquant que l'action anti-inflammatoire des nanocristaux d'alliage nickel-cobalt repose sur leur absorption cellulaire.
Pour déterminer si les effets anti-inflammatoires des nanocristaux d'alliage nickel-cobalt sont attribués à leur morphologie géométrique ou à leur composition élémentaire, les auteurs ont synthétisé des nanoparticules de nickel et des nanoparticules de cobalt dans des conditions identiques à celles des contrôles, qui présentaient des morphologies distinctes par rapport aux nanocristaux d'alliage nickel-cobalt. . Cependant, les nanoparticules de nickel et les nanoparticules de cobalt ont également inhibé de manière significative l'activation de l'inflammasome.
Par conséquent, les auteurs ont attribué l’effet inhibiteur des nanocristaux d’alliage nickel-cobalt à la composition élémentaire plutôt qu’à leur forme géométrique. Ces résultats suggèrent que les nanomatériaux contenant du nickel et du cobalt pourraient offrir des opportunités pour concevoir des nanomédicaments dotés de propriétés anti-inflammatoires.
Révéler les mécanismes biologiques sous-jacents à l’action des nanomatériaux est crucial pour leurs applications médicales potentielles. Cependant, élucider le mécanisme biologique par lequel ces nanocristaux anti-inflammatoires à large spectre inhibent l'activation de l'inflammasome pose des défis importants en utilisant des approches expérimentales biologiques conventionnelles.
Pour résoudre ce problème, les chercheurs ont effectué le séquençage de l'ARN et le test de la chromatine accessible par la transposase avec séquençage (ATAC-Seq), conduisant à l'identification d'un ARN non codant précédemment signalé, Neat1, connu pour être impliqué dans l'assemblage de l'inflammasome. Suite au traitement avec les nanocristaux d'alliage nickel-cobalt, l'expression de Neat1 a été considérablement réduite.
Des études antérieures ont démontré que la régulation négative de l'expression de Neat1 à elle seule inhibe de manière significative l'activation des inflammasomes NLRP3, NLRC4 et AIM2. Les résultats d'ATAC-Seq ont révélé une réduction significative de l'accessibilité à la chromatine du corps du gène et des régions promotrices de Neat1 dans le groupe traité par des nanocristaux d'alliage nickel-cobalt, suggérant que l'inhibition de l'activation de l'inflammasome par les nanocristaux d'alliage nickel-cobalt est obtenue grâce à la suppression de la transcription Neat1 plutôt que de favoriser sa dégradation.
Cette étude a été menée en collaboration par le Dr Shu-Hong Yu, le Dr Long-Ping Wen et le Dr Kun Qu de l'Université des sciences et technologies de Chine, ainsi que le professeur Yang Lu de l'Université de technologie de Hefei.
Plus d'informations : Jun Lin et al, Les nanocristaux d'alliage nickel-cobalt inhibent l'activation des inflammasomes, National Science Review (2023). DOI : 10.1093/nsr/nwad179
Fourni par Science China Press