Les nanopinces optothermiques sont une méthode de conception optique innovante qui a révolutionné les techniques optiques classiques pour capturer une large gamme de nanoparticules. Bien que le champ de température optothermique puisse être utilisé pour la régulation in situ des nanoparticules, il reste des défis à relever pour identifier leur potentiel de régulation des bionanoparticules.
Pour observer les effets synergiques de la manipulation optothermique et de la biodétection basée sur les répétitions palindromiques courtes régulièrement espacées (CRISPR), les chercheurs ont développé une combinaison de nanopinces optothermiques alimentées par CRISPR, abrégées en CRONT.
Dans un nouveau rapport dans Light :Science &Applications , Jiajie Chen et une équipe de recherche en génie optoélectronique, génie biomédical et physique, ont accompli cet objectif en exploitant la diffusiophorèse et les flux thermo-osmotiques pour l'excitation optothermique en enrichissant avec succès des nanoparticules d'or fonctionnalisées par l'ADN, des protéines associées à CRISPR et des brins d'ADN.
Les scientifiques se sont appuyés sur un schéma optothermique pour améliorer la détection du polymorphisme mononucléotidique associé à CRISPR au niveau d'une seule molécule, afin d'introduire une nouvelle méthode basée sur CRISPR pour observer le clivage des nucléotides. Les chercheurs ont étudié cette approche innovante en tant que domaine universel du diagnostic, de la biophotonique et de la bionanotechnologie au point d'intervention.
En 1986, Arthur Ashkin a inventé des pincettes optiques pour réguler des nano-objets à distance et a reçu un prix Nobel de physique en 2018 pour cette découverte révolutionnaire et sa contribution aux systèmes biologiques. Alors que les pinces optiques classiques dépendent de la transformation de l'impulsion de la lumière, des combinaisons interdisciplinaires en matière d'optique plasmonique, de champ électrique et de température ont efficacement permis d'en surmonter les limites.
Une variété d’approches innovantes ont émergé pour offrir de nouvelles opportunités en matière d’analyse et de régulation des particules. Les nanopinces optothermiques utilisent des forces thermodynamiques induites par l'optique pour réguler les nanoparticules à l'échelle micronique avec une précision inférieure au micron.
Par rapport aux pinces optiques traditionnelles, les pinces optothermiques nécessitent une densité de puissance plus faible, ce qui en fait une alternative intéressante pour la détection biologique, tout en réduisant les effets optiques indésirables sur les échantillons biologiques. Étant donné que les effets thermiques jouent un rôle clé au cours de divers processus biologiques, il est possible d'exploiter les capacités du champ de température pour des applications pratiques.
La méthode peut être utilisée pour réguler les bionanoparticules allant de l'échelle micro à nano pour inclure des bactéries et des cellules vivantes, ainsi que des molécules et des protéines d'ADN simple et double brin.
Combiner CRISPR avec des nanopinces – CRONT
Le système de répétitions palindromes courtes et régulièrement espacées en cluster (CRISPR) offre lui-même un outil d'édition génétique remarquable, qui a également reçu un prix Nobel en 2020. La méthode comprenait une protéine nucléase associée à CRISPR et un ARN guide spécifique à l'ADN cible.
Les biophysiciens et les bioingénieurs souhaitent de plus en plus améliorer la sensibilité et la polyvalence de la détection de l'ADN en combinant le système CRISPR-Cas avec de nouveaux modes de détection.
Pour surmonter les limites existantes de la méthode, Chen et ses collègues ont conçu une plate-forme de pincement optothermique universellement applicable connue sous le nom de nanopinces optothermiques alimentées par CRISPR pour identifier les bionanoparticules et ont utilisé cette configuration pour identifier des molécules d'ADN in situ, sans amplification d'acide nucléique. Les expériences ont fourni des volumes de détection ultra-faibles à 10 μL pour identifier les polymorphismes mononucléotidiques afin d'étudier la diversité génétique, la susceptibilité aux maladies et la réponse aux médicaments, afin de répondre aux exigences futures de la recherche génomique et de la médecine.
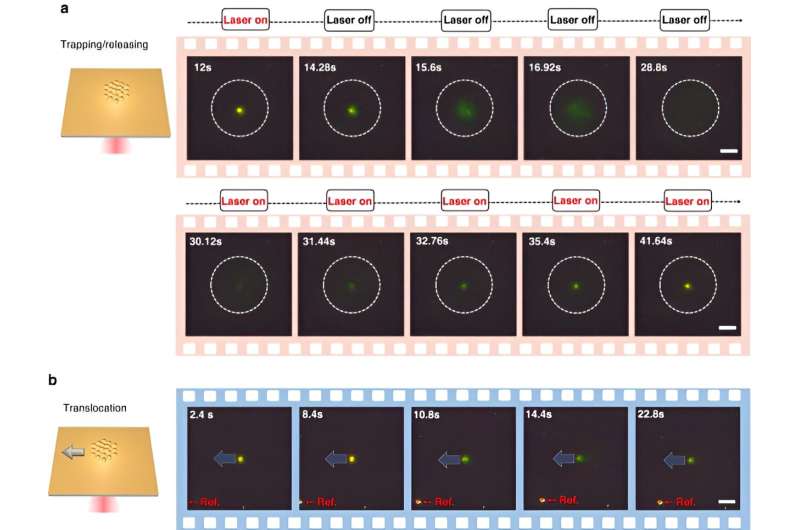
Pour activer CRONT (nanopinces optothermiques alimentées par CRISPR), les scientifiques ont conçu une chambre microfluidique avec une fine couche de film d'or déposée sur le verre de protection. Lorsque l’équipe a irradié le film d’or avec un éclairage laser, elle a généré un champ de température entourant le point laser. Les scientifiques ont détaillé les conditions optimales des réactions CRISPR et ont initié le clivage du conjugué nanofilm ADN-or, en utilisant la microscopie à fond noir.
Ils ont ajouté un polymère non ionique de polyéthylène glycol (PEG) dans la solution aqueuse comme tensioactif biologique pour une excellente biocompatibilité.
La présence de plusieurs nanoparticules et leur mobilité thermophorétique variable ont généré une concentration distincte de soluté. Lorsque des solutés présentant des concentrations plus élevées influençaient ceux ayant des concentrations plus faibles par le biais de la pression osmotique, les résultats entraînaient une interaction connue sous le nom de force diffusiophorétique. Cette enquête systématique a mis en évidence le potentiel d'inclusion de CRONT pour procéder à l'identification biomoléculaire.
Combinaison optothermique de protéines et d'ADN
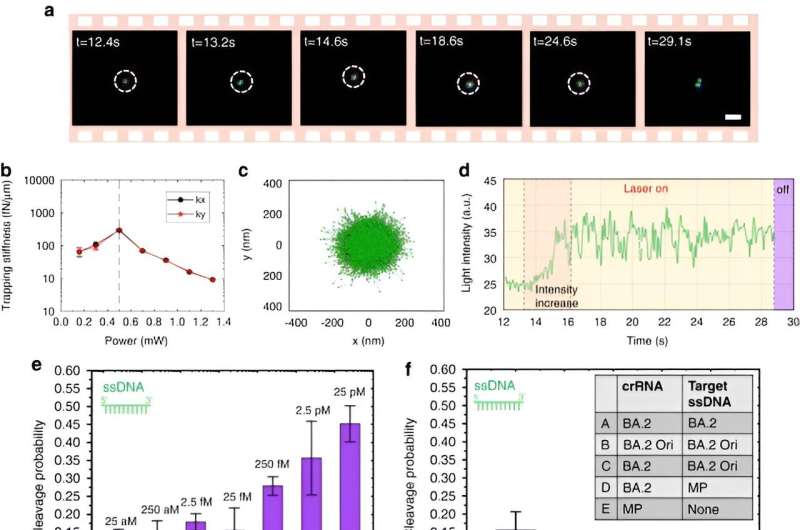
Pour activer les nanopinces optothermiques alimentées par CRISPR, Chen et ses collègues ont étudié les comportements d'agrégation des protéines et des ADN en utilisant un marquage par fluorescence où la longueur de la tige rigide générait un gradient de concentration de polyéthylène glycol. Bien qu’une puissance laser plus élevée n’augmente pas continuellement le taux d’accumulation en raison d’un flux thermo-osmotique élargi, l’accumulation d’ADN simple brin était supérieure à celle de l’ADN double brin. Bien que les accumulations de protéines soient rarement étudiées en biophysique, les protéines Cas12a marquées par fluorescence ont montré une tendance à former de légères accumulations en forme d'anneaux, où l'augmentation de la puissance du laser augmentait leur taux d'accumulation.
L’équipe a en outre réalisé des expériences sur des protéines couramment incorporées telles que l’albumine sérique bovine avec marquage FITC. En présence d'un champ optothermique, cette distribution protéique est restée aléatoire et non affectée par la présence de molécules de polyéthylène glycol.
Chen et son équipe ont noté comment le champ optothermique associé aux nanopinces optothermiques alimentées par CRISPR (CRONT) fournissait une température appropriée pour la biodétection basée sur CRISPR, avec la capacité d'enrichir les bionanoparticules pour détecter l'ADN à des concentrations ultra-faibles, au lieu du seul mouvement brownien qui est régi par la détection de la diffusion.
Les scientifiques ont inclus le programme CRISPR-12a pour examiner l’ADN ambiant simple brin. Le système CRONT a réussi à identifier les ADN au niveau d'une molécule unique pour les polymorphismes mononucléotidiques avec une sensibilité et une spécificité élevées.
De cette manière, Jiajie Chen et ses collègues ont incorporé la diffusiophorèse et les flux thermo-osmotiques dans la couche limite d'un film optothermique réactif pour montrer une nouvelle méthode permettant de réguler les nanopinces optothermiques alimentées par CRISPR à l'échelle nanométrique.
Cette méthode a permis la mise en œuvre immédiate de la biodétection basée sur CRISPR avec un volume de détection ultrafaible.
Les pinces optiques sont dotées de l'identification de l'ADN grâce à des systèmes de biodétection basés sur CRISPR comme moyen d'enrichissement de biomolécules pour cliver le complexe CRISPR. De telles nanopinces optothermiques ou systèmes CRONT alimentés par CRISPR sont extrêmement prometteuses pour faire progresser la compréhension de processus biologiques complexes en tant que sonde de détection polyvalente dans la recherche biomédicale, la découverte de médicaments et le diagnostic de maladies.
Plus d'informations : Jiajie Chen et al, Nanopinces optothermiques alimentées par CRISPR :manipulations diverses de bio-nanoparticules et identification de nucléotides uniques, Lumière :science et applications (2023). DOI :10.1038/s41377-023-01326-9
Informations sur le journal : La lumière :science et applications
© 2023 Réseau Science X