Certains vaccins contre la COVID-19 utilisaient des nanoparticules lipidiques (LNP) de manière sûre et efficace pour délivrer l’ARN messager aux cellules. Une nouvelle étude du MIT montre que différentes nanoparticules pourraient être utilisées pour un traitement potentiel contre la maladie d'Alzheimer (MA). Lors de tests réalisés sur plusieurs modèles de souris et sur des cellules humaines en culture, une nouvelle formulation de LNP a efficacement délivré de petits ARN interférents (ARNsi) aux cellules immunitaires des microglies du cerveau pour supprimer l'expression d'une protéine liée à une inflammation excessive dans la maladie d'Alzheimer.
Dans une étude antérieure, les chercheurs ont montré que le blocage des conséquences de l'activité de la protéine PU.1 contribue à réduire la neuroinflammation et la pathologie liées à la maladie d'Alzheimer. Les nouveaux résultats, rapportés dans la revue Advanced Materials , obtenez une réduction de l'inflammation en limitant directement l'expression du gène Spi1 qui code pour PU.1.
Plus généralement, la nouvelle étude démontre également une nouvelle façon de délivrer l'ARN aux microglies, qui ont été difficiles à cibler jusqu'à présent.
Li-Huei Tsai, co-auteure principale de l'étude, professeur de neurosciences à Picower et directrice de l'Institut Picower pour l'apprentissage, la mémoire et le vieillissement du cerveau, a déclaré qu'elle émettait l'hypothèse que les LNP pourraient fonctionner comme un moyen d'introduire le siARN dans la microglie, car les cellules, qui éliminent déchets dans le cerveau, ont une forte propension à absorber les molécules lipidiques.
Elle en a discuté avec Robert Langer, professeur à l'Institut David Koch, largement connu pour ses travaux fondateurs sur l'administration de médicaments par nanoparticules ; ils ont décidé de tester l'idée de réduire l'expression de PU.1 avec un siARN délivré par LNP.
"Je me souviens encore du jour où j'ai demandé à rencontrer Bob pour discuter de l'idée de tester les LNP en tant que charge utile pour cibler les microglies inflammatoires", a déclaré Tsai, membre du corps professoral du Département des sciences du cerveau et des sciences cognitives. "Je suis très reconnaissant à la Fondation JPB, qui a soutenu cette idée sans aucune preuve préliminaire."
Jason Andresen, étudiant diplômé du Langer Lab, et William Ralvenius, ancien postdoctorant du Tsai Lab, ont dirigé les travaux et sont les co-auteurs principaux de l'étude. Owen Fenton, ancien postdoctorant du Langer Lab et maintenant professeur adjoint à la Eshelman School of Pharmacy de l'Université de Caroline du Nord, est auteur co-correspondant avec Tsai et Langer. Langer est professeur de génie chimique, de génie biologique et de l'Institut Koch pour la recherche intégrative sur le cancer.
La manière la plus simple de tester si l'ARNsi pouvait supprimer thérapeutiquement l'expression de PU.1 aurait été d'utiliser un dispositif d'administration déjà disponible, mais l'une des premières découvertes de l'étude est qu'aucun des huit réactifs disponibles dans le commerce ne pouvait transfecter de manière sûre et efficace des cellules cultivées. cellules humaines ressemblant à des microglies en laboratoire.
Au lieu de cela, l'équipe a dû optimiser un LNP pour faire le travail. Les LNP ont quatre composants principaux, et en modifiant la structure de deux d’entre eux et en faisant varier le rapport lipides/ARN, les chercheurs ont pu proposer sept formulations à essayer. Il est important de noter que leurs tests comprenaient l’essai de leurs formulations sur des microglies cultivées qu’ils avaient induites dans un état inflammatoire. Après tout, cet état est celui dans lequel le traitement proposé est nécessaire.
Parmi les sept candidats, celui de l'équipe nommé "MG-LNP" s'est distingué par son efficacité de livraison particulièrement élevée et la sécurité d'une cargaison d'ARN test.
Ce qui fonctionne dans un plat ne fonctionne parfois pas dans un organisme vivant, c'est pourquoi l'équipe a ensuite testé l'efficacité et la sécurité de ses formulations LNP chez la souris. En testant deux méthodes d'injection différentes, dans le corps ou dans le liquide céphalo-rachidien (LCR), ils ont découvert que l'injection dans le LCR garantissait une bien plus grande efficacité dans le ciblage des microglies sans affecter les cellules d'autres organes.
Parmi les sept formulations, MG-LNP s’est à nouveau révélée la plus efficace pour transfecter les microglies. Langer a déclaré qu'il pensait que cela pourrait potentiellement ouvrir un jour de nouvelles façons de traiter certaines maladies cérébrales avec des nanoparticules.
Une fois qu’ils ont su que le MG-LNP pouvait délivrer une cargaison test à la microglie à la fois dans des cultures de cellules humaines et chez des souris, les scientifiques ont ensuite testé si son utilisation pour délivrer un siARN supprimant PU.1 pouvait réduire l’inflammation dans la microglie. Dans les cultures cellulaires, une dose relativement faible a permis d'obtenir une réduction de 42 % de l'expression de PU.1 (ce qui est une bonne chose car les microglies ont besoin d'au moins un peu de PU.1 pour vivre).
En effet, la transfection MG-LNP n’a causé aucun dommage aux cellules. Il a également réduit de manière significative la transcription des gènes dont l'expression de PU.1 augmente dans la microglie, indiquant qu'il peut réduire plusieurs marqueurs inflammatoires.
Dans toutes ces mesures et d'autres, le MG-LNP a surpassé un réactif disponible dans le commerce appelé RNAiMAX que les scientifiques ont testé en parallèle.
"Ces résultats soutiennent l'utilisation de l'administration de siARN anti-PU.1 médiée par MG-LNP comme traitement potentiel pour les maladies neuroinflammatoires", ont écrit les chercheurs.
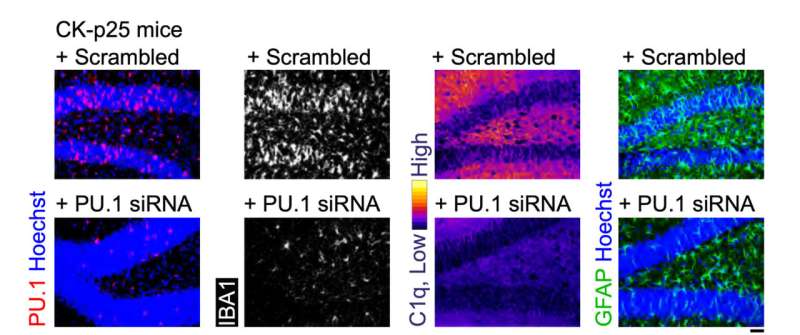
La dernière série de tests a évalué les performances du MG-LNP, délivrant le siARN dans deux modèles murins d'inflammation cérébrale. Dans l’un d’entre eux, des souris ont été exposées au LPS, une molécule qui simule une infection et stimule une réponse inflammatoire systémique. Dans l'autre modèle, les souris présentent une neurodégénérescence et une inflammation sévères lorsqu'une enzyme appelée CDK5 devient hyperactivée par une protéine appelée p25.
Dans les deux modèles, l'injection de MG-LNP portant le siARN anti-PU.1 a réduit l'expression de PU.1 et des marqueurs inflammatoires, un peu comme dans les cellules humaines en culture.
"L'administration par MG-LNP d'ARNsi anti-PU.1 peut potentiellement être utilisée comme traitement anti-inflammatoire chez les souris souffrant d'inflammation systémique et dans le modèle murin CK-p25 de neuroinflammation de type MA", ont conclu les scientifiques, qualifiant les résultats de " "preuve de principe." Des tests supplémentaires seront nécessaires avant que l'idée puisse être testée sur des patients humains.
Plus d'informations : William T. Ralvenius et al, L'administration nanoparticulaire de siARN anti-PU.1 via une administration intracisternale localisée réduit la neuroinflammation, Matériaux avancés (2023). DOI : 10.1002/adma.202309225
Informations sur le journal : Matériaux avancés
Fourni par le Massachusetts Institute of Technology