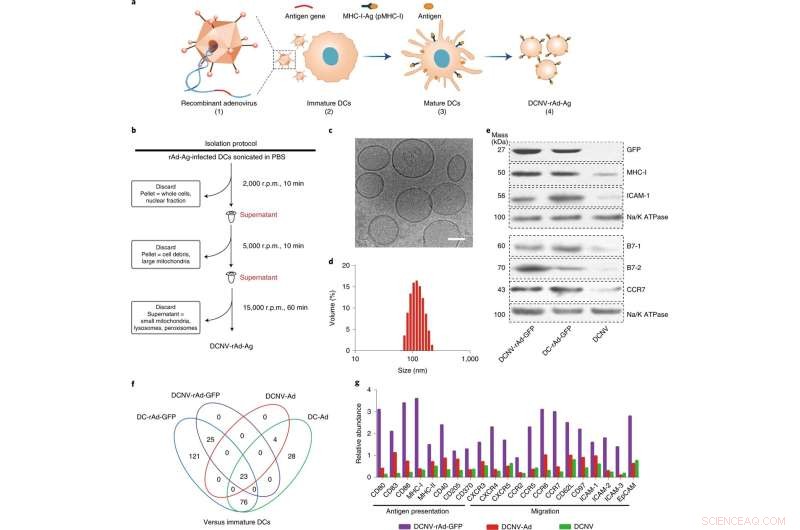
Génération et caractérisation de DCNV-rAd-Ag. a, Génération de DCNV dérivés de cellules dendritiques matures infectées par un adénovirus. (1) Les gènes de l'antigène spécifique de la tumeur ont été génétiquement modifiés dans le vecteur adénovirus. (2) L'adénovirus recombinant a infecté les cellules DC2.4 immatures pour exprimer l'antigène modifié sur la surface cellulaire et le stimuler. (3) Différenciation, maturation et présentation antigénique. (4) Récolte de la membrane cellulaire mature induite et préparation de DCNV-rAd-Ag. b, Illustration schématique de la génération de DCNV-rAd-Ag. c, d, cryo-microscopie électronique ( c ) et analyses de diffusion dynamique de la lumière ( d ) ont montré un DCNV-rAd-Ag uniforme (diamètre moyen d'environ 108 nm, indice de polydispersité =0, 14) avec une morphologie semblable à une vésicule. Barre d'échelle, 50 nm. e, Le Western blot sur les protéines membranaires de DCNV-rAd-GFP démontre une teneur en protéines similaire à la surface par rapport à celle des cellules parentales. Les panneaux c à e montrent les résultats représentatifs de deux expériences indépendantes avec des résultats similaires. f, comparaison des protéines liées à la réponse immunitaire régulées positivement dans les NV et les DC. g, L'abondance relative de la présentation de l'antigène et des protéines liées à la migration sur DCNV-rAd-GFP. r.p.m., tours par minute. CCR, récepteur de chimiokine CC ; CXCR, récepteur de chimiokine C-X-C ; EpCAM, molécule d'adhésion cellulaire épithéliale; ICAM 1, molécule d'adhésion intercellulaire 1; pMHC-I, peptide-major histocompatibility complex class I. Crédit :Nature Nanotechnology (2022). DOI :10.1038/s41565-022-01098-0
Alors que les gens du monde entier attendent avec impatience une espérance de vie plus longue, les cancers malins continuent de menacer la santé humaine. L'exploration et le développement de l'immunothérapie visent à rechercher de nouvelles percées pour le traitement des tumeurs solides.
L'établissement réussi de l'immunité anti-tumorale nécessite l'activation, l'expansion et la différenciation des lymphocytes spécifiques de l'antigène. Ce processus dépend en grande partie des interactions spécifiques entre les diverses cellules T et les cellules présentatrices d'antigène (APC) dans le corps. Cependant, les vaccins antitumoraux existants, tels que les vaccins néo-antigènes et divers vaccins vectoriels, reposent tous sur des interactions aléatoires avec les APC dans le corps. De plus, des interactions inappropriées peuvent entraîner le silence d'autres réponses immunitaires.
Bien qu'il ait été démontré que l'immunothérapie basée sur les points de contrôle immunitaire a un grand potentiel, seule une petite proportion de patients répond pleinement à cette thérapie, et les mécanismes moléculaires pertinents doivent être explorés plus avant. Ce mode de livraison est cependant complexe et inefficace.
Dans un développement révolutionnaire, une équipe de scientifiques dirigée par le professeur Chen Xiaoyuan de la chaire de Narat Muzayyin de la NUS Yong Loo Lin School of Medicine et le professeur Liu Gang de l'Université de Xiamen a formulé un nouveau vaccin qui a montré une grande efficacité dans le traitement des tumeurs solides, atteignant élimination complète des tumeurs solides et induisant une mémoire immunitaire de longue durée. Cela empêche la rechute de la croissance tumorale que le patient présentait à l'origine et fournit une immunité contre des types de tumeurs similaires. Cela a été prouvé par l'application de ce vaccin sur des modèles tumoraux de mélanome. Leurs résultats sont publiés dans Nature Nanotechnology .
L'équipe a pu concevoir une membrane de cellule dendritique (un type d'APC) qui a été utilisée pour stimuler naturellement le système immunitaire et activer l'immunité anti-tumorale multidimensionnelle. Cela a été fait grâce à une plate-forme vaccinale à nanovésicules d'auto-présentation d'antigène et d'inversion d'immunosuppression, qui a incité l'équipe à créer son surnom, ASPIRE.
Le système de vaccination ASPIRE peut rapidement susciter des réponses immunitaires appropriées et spécifiques à l'antigène d'une manière que les méthodes de vaccination traditionnelles ne pouvaient pas. Ce mode de présentation de l'antigène améliore considérablement l'efficacité de l'activation immunitaire, ce qui facilite l'efficacité élevée de ce nouveau vaccin par rapport aux autres vaccins actuellement disponibles. En outre, le vaccin peut également activer à la fois les cellules T précédemment non exposées et les cellules T épuisées, ce qui facilite les capacités immunitaires anti-tumorales supérieures d'ASPIRE.
« Nous sommes enthousiasmés par le potentiel de cette technologie de plate-forme pour une application ultérieure dans d'autres maladies également, telles que l'infection virale chronique, dans laquelle l'épuisement des lymphocytes T se produit souvent pendant l'infection et empêche le contrôle viral optimal », a déclaré le professeur Chen. "Ensuite, l'équipe espère établir un mode opératoire standard pour la synthèse à grande échelle du vaccin, avec un contrôle de qualité approprié des vésicules membranaires, pour une traduction clinique", a-t-il ajouté.
S'exprimant de manière indépendante sur l'étude, le professeur Chng Wee Joo, consultant principal de la division d'hématologie du département d'hématologie-oncologie de l'Institut national du cancer de l'université de Singapour et spécialiste du myélome, a déclaré :"Le domaine de l'immunothérapie contre le cancer offre un immense espoir au cancer Cependant, les technologies actuelles présentent certaines lacunes. La présente innovation du professeur Chen et de ses collègues surmonte certaines de ces lacunes et améliore l'efficacité et
la durabilité de la réponse immunitaire à ces traitements. une avancée qui aura un impact important sur les patients." Nanotechnologie vaccinale émergente