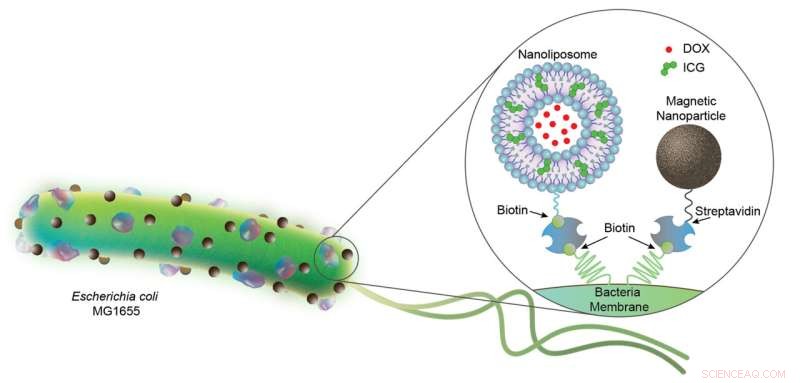
Figure 1. Biohybrides bactériens portant des nanoliposomes (200 nm) et des nanoparticules magnétiques (100 nm). Les nanoliposomes sont chargés de DOX chimiothérapeutique et d'agent photothermique ICG, et les deux cargaisons sont conjuguées à la bactérie E. coli (2 à 3 µm de longueur) via des interactions biotine-streptavidine. Crédit :Progrès scientifiques (2022). DOI :10.1126/sciadv.abo6163
Une équipe de scientifiques du département d'intelligence physique de l'Institut Max Planck pour les systèmes intelligents a combiné la robotique avec la biologie en équipant les bactéries E. coli de composants artificiels pour construire des microrobots biohybrides. Tout d'abord, comme on peut le voir sur la figure 1, l'équipe a attaché plusieurs nanoliposomes à chaque bactérie. Sur leur cercle extérieur, ces supports de forme sphérique renferment un matériau (ICG, particules vertes) qui fond lorsqu'il est éclairé par une lumière proche infrarouge. Plus loin vers le milieu, à l'intérieur du noyau aqueux, les liposomes encapsulent des molécules de médicaments chimiothérapeutiques solubles dans l'eau (DOX).
Le deuxième composant que les chercheurs ont attaché à la bactérie est constitué de nanoparticules magnétiques. Lorsqu'elles sont exposées à un champ magnétique, les particules d'oxyde de fer servent de booster à ce micro-organisme déjà très mobile. De cette façon, il est plus facile de contrôler la nage des bactéries - une conception améliorée vers une application in vivo. Pendant ce temps, la corde liant les liposomes et les particules magnétiques à la bactérie est un complexe de streptavidine et de biotine très stable et difficile à rompre, qui a été développé quelques années auparavant et rapporté dans un Nature article, et est utile lors de la construction de microrobots biohybrides.
Les bactéries E. coli sont des nageurs rapides et polyvalents qui peuvent naviguer à travers des matériaux allant des liquides aux tissus très visqueux. Mais ce n'est pas tout, ils disposent également de capacités de détection très avancées. Les bactéries sont attirées par des gradients chimiques tels que de faibles niveaux d'oxygène ou une acidité élevée, tous deux répandus à proximité des tissus tumoraux. Le traitement du cancer en injectant des bactéries à proximité est connu sous le nom de thérapie antitumorale à médiation bactérienne. Les micro-organismes affluent vers l'endroit où se trouve la tumeur, s'y développent et activent ainsi le système immunitaire des patients. La thérapie tumorale médiée par les bactéries est une approche thérapeutique depuis plus d'un siècle.
Au cours des dernières décennies, les scientifiques ont cherché des moyens d'augmenter encore plus les superpuissances de ce micro-organisme. Ils ont équipé les bactéries de composants supplémentaires pour les aider à combattre. Cependant, l'ajout de composants artificiels n'est pas une tâche facile. Des réactions chimiques complexes sont en jeu et le taux de densité des particules chargées sur les bactéries est important pour éviter la dilution. L'équipe de Stuttgart a maintenant placé la barre assez haut. Ils ont réussi à équiper 86 bactéries sur 100 avec des liposomes et des particules magnétiques.
Les scientifiques ont montré comment ils avaient réussi à piloter de l'extérieur une solution aussi dense à travers différents parcours. Tout d'abord, à travers un canal étroit en forme de L avec deux compartiments à chaque extrémité, avec un sphéroïde tumoral dans chacun. Deuxièmement, une configuration encore plus étroite ressemblant à de minuscules vaisseaux sanguins. Ils ont ajouté un aimant permanent supplémentaire sur un côté et ont montré comment ils contrôlent avec précision les microrobots chargés de médicament vers les sphéroïdes tumoraux. Et troisièmement, pour aller encore plus loin, l'équipe a dirigé les microrobots à travers un gel de collagène visqueux (ressemblant à du tissu tumoral) avec trois niveaux de rigidité et de porosité, allant de doux à moyen à rigide. Plus le collagène est rigide, plus le réseau de chaînes de protéines est serré, plus il devient difficile pour les bactéries de trouver un chemin à travers la matrice (Figure 2). L'équipe a montré qu'une fois qu'elles ajoutent un champ magnétique, les bactéries parviennent à naviguer jusqu'à l'autre extrémité du gel car les bactéries ont une force plus élevée. En raison de l'alignement constant, les bactéries ont trouvé un chemin à travers les fibres.
Une fois que les microrobots sont accumulés au point souhaité (le sphéroïde tumoral), un laser proche infrarouge génère des rayons avec des températures allant jusqu'à 55 degrés Celsius, déclenchant un processus de fusion du liposome et une libération des médicaments enfermés. Un faible niveau de pH ou un environnement acide provoque également l'ouverture des nanoliposomes, d'où la libération automatique des médicaments près d'une tumeur.
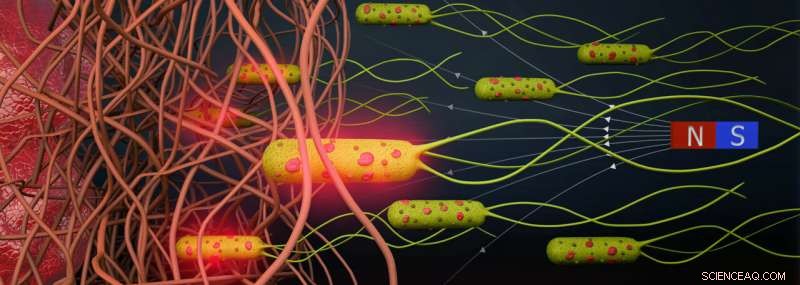
Figure 2. Schematic showing bacterial biohybrid microrobots magnetically guided through fibrous environments. Bacterial biohybrids can release their payload upon NIR irradiation. Credit:Science Advances (2022). DOI:10.1126/sciadv.abo6163
"Imagine we would inject such bacteria based microrobots into a cancer patient's body. With a magnet, we could precisely steer the particles towards the tumor. Once enough microrobots surround the tumor, we point a laser at the tissue and by that trigger the drug release. Now, not only is the immune system triggered to wake up, but the additional drugs also help destroy the tumor," says Birgül Akolpoglu, a Ph.D. student in the Physical Intelligence Department at MPI-IS. She is the first author of the publication titled "Magnetically steerable bacterial microrobots moving in 3D biological matrices for stimuli-responsive cargo delivery" co-led by former postdoctoral researcher in the Physical Intelligence Department, Dr. Yunus Alapan. It was published in Science Advances on July 15, 2022.
"This on-the-spot delivery would be minimally invasive for the patient, painless, bear minimal toxicity and the drugs would develop their effect where needed and not inside the entire body," Alapan adds.
"Bacteria-based biohybrid microrobots with medical functionalities could one day battle cancer more effectively. It is a new therapeutic approach not too far away from how we treat cancer today," says Prof. Dr. Metin Sitti, who leads the Physical Intelligence Department and is the last author of the publication. "The therapeutic effects of medical microrobots in seeking and destroying tumor cells could be substantial. Our work is a great example of basic research that aims to benefit our society." + Explore further