Des filaments groupés ont été produits à partir des cristaux via une réponse au stress oxydatif de cystéinyl thiols après isolement des cristaux à partir de cellules vivantes. Cette méthode sera considérée comme une avancée utile dans la science des nano-biomatériaux et la chimie supramoléculaire en tant que méthode de synthèse pour la construction d'assemblages durables à l'aide de cristaux de protéines. Crédit : Tokyo Tech
Les protéines font sans aucun doute partie des biomolécules les plus fascinantes, et ils remplissent de nombreuses fonctions qui (à nos yeux) séparent la vie de la matière inanimée. Les assemblages de protéines multimoléculaires ont même des fonctions structurelles à grande échelle, comme en témoignent les plumes, Cheveu, et des écailles chez les animaux. Il ne faut pas s'étonner que, avec les progrès des nanotechnologies avancées et de la bio-ingénierie, les assemblages de protéines artificielles ont trouvé des applications dans divers domaines, y compris la catalyse, stockage moléculaire, et les systèmes d'administration de médicaments.
Cependant, produire des assemblages de protéines ordonnées reste un défi. Il est particulièrement difficile d'obtenir des monomères, les éléments constitutifs des protéines, s'assembler de manière stable dans les structures souhaitées ; cela nécessite généralement une conception et un contrôle très précis des conditions de synthèse, tels que le pH (acidité) et la température. Des études récentes ont trouvé des moyens de contourner ce problème en utilisant des cristaux de protéines - des arrangements moléculaires solides qui se produisent naturellement dans certains organismes - comme matrices précurseurs pour produire des assemblages de protéines.
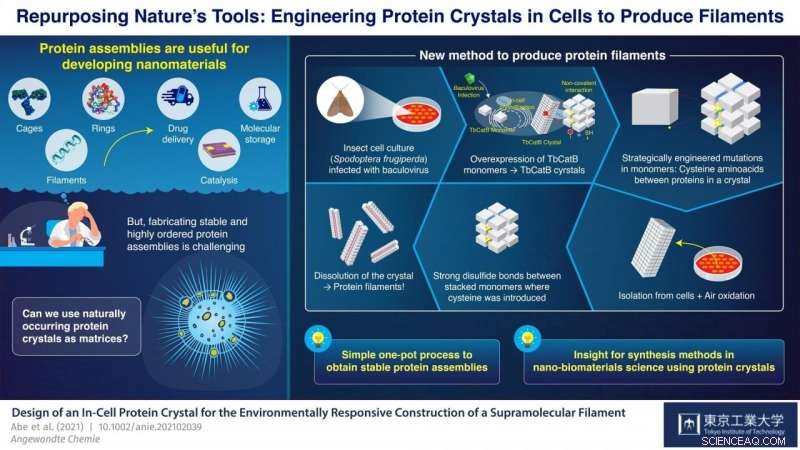
À l'Institut de technologie de Tokyo, Japon, une équipe de scientifiques dirigée par le professeur Takafumi Ueno a travaillé sur une approche prometteuse pour synthétiser des assemblages de protéines à partir de cristaux de protéines. Leur stratégie consiste à introduire des mutations dans le code génétique d'un organisme qui produit naturellement des cristaux de protéines. Ces mutations provoquent la formation de liaisons disulfure (S-S) entre les monomères à des emplacements très spécifiques dans les cristaux. Les cristaux sont ensuite dissous, mais au lieu de se décomposer complètement en leurs monomères individuels comme d'habitude, les liaisons S-S nouvellement introduites maintiennent des groupes de monomères ensemble et les cristaux se divisent en plusieurs des assemblages de protéines souhaités. Avec cette approche, L'équipe d'Ueno a réussi à synthétiser des cages et des tubes à protéines en utilisant essentiellement des cellules vivantes comme imprimantes nano-3D.
Dans leur dernière étude, qui a été publié dans Angewandte Chemie Édition Internationale , l'équipe a démontré une autre application de sa nouvelle stratégie ; cette fois pour la synthèse de filaments protéiques groupés. Ils ont utilisé une culture de cellules d'insectes (Spodoptera frugiperda) infectées par un virus qui a provoqué la surexpression d'un monomère appelé « TbCatB ». Ces monomères s'agrègent naturellement à l'intérieur des cellules en cristaux de protéines, qui y sont maintenus ensemble par les interactions non covalentes relativement faibles entre les monomères. Les scientifiques ont introduit stratégiquement deux mutations dans les cellules de sorte que chaque monomère ait deux groupes thiol (-SH) de cystéine aux points d'interface critiques avec d'autres monomères.
Les cristaux ont été extraits des cellules et laissés s'oxyder à température ambiante, ce qui a provoqué la transformation des groupes thiol en de fortes liaisons S-S entre des monomères adjacents dans une seule direction par autooxydation sous air. Lorsque les cristaux ont été dissous, ces liaisons disulfure, avec quelques interactions non covalentes persistantes, a entraîné la formation de filaments de protéines groupés de deux monomères de large, environ 8,3 nanomètres. « Avec notre stratégie, nous avons obtenu un arrangement très précis des molécules de protéines tout en supprimant l'agrégation aléatoire de monomères due aux liaisons sulfure indésirables, le tout dans un processus monobloc relativement simple, " souligne Ueno.
Globalement, l'approche démontrée par l'équipe de Tokyo Tech se présente comme un moyen innovant de synthétiser des structures protéiques par génie génétique rationnel et en utilisant les outils naturellement disponibles pour les cellules de certains organismes. "Nous considérons notre méthode de synthèse comme une avancée utile dans la science des nano-biomatériaux et la chimie supramoléculaire pour produire des assemblages stables souhaités à partir de cristaux de protéines, " conclut Ueno. Seul le temps dira quelles autres structures moléculaires utiles peuvent être produites en utilisant cette stratégie et quelles applications intéressantes elles trouveront.