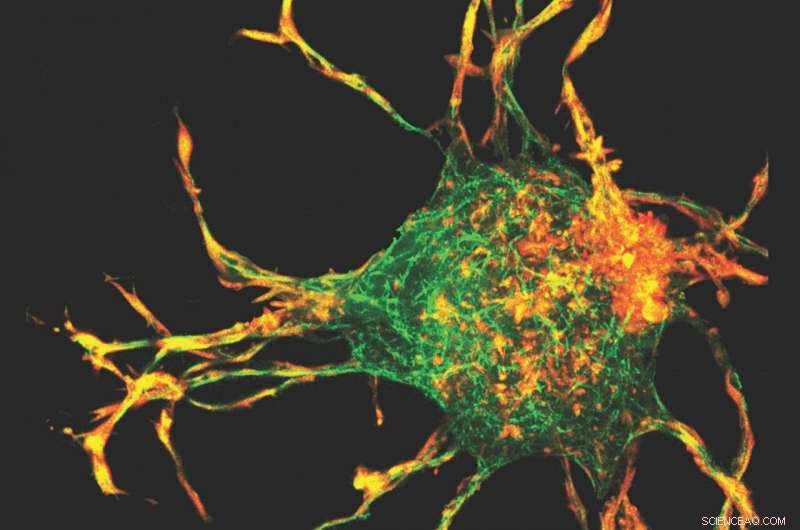
Les chercheurs ont utilisé une technique de cartographie 3D - la première fois qu'elle a été appliquée au collagène - ainsi qu'un modèle informatique pour calculer les champs de contrainte et de contrainte 3D créés par les saillies des cellules. Crédit :image de courtoisie
Quand nous avons une blessure sur la peau, les cellules de notre corps se mobilisent rapidement pour le réparer. Bien que l'on sache comment les cellules guérissent les plaies et comment se forment les cicatrices, une équipe dirigée par des chercheurs de l'Université de Washington à St. Louis a déterminé pour la première fois comment le processus commence, qui peut fournir de nouvelles informations sur la cicatrisation des plaies, fibrose et métastase cancéreuse.
L'équipe, dirigé par Delaram Shakiba, un boursier postdoctoral du NSF Science and Technology Center for Engineering Mechanobiology (CEMB) à la McKelvey School of Engineering, découvert la façon dont les fibroblastes, ou des cellules communes dans le tissu conjonctif, interagir avec la matrice extracellulaire, qui fournit un support structurel ainsi que des indices biochimiques et biomécaniques aux cellules. L'équipe a découvert un processus récursif qui se déroule entre les cellules et leur environnement ainsi que des structures dans les cellules qui étaient auparavant inconnues.
Les résultats de la recherche ont été publiés dans ACS Nano le 28 juillet. Les auteurs principaux de l'article sont Guy Genin, le professeur Harold et Kathleen Faught de génie mécanique à la McKelvey School of Engineering, et Elliot Elson, professeur émérite de biochimie et de biophysique moléculaire à la Faculté de médecine.
« Efforts cliniques pour prévenir la progression des maladies fibrocontractiles, comme les cicatrices et la fibrose, ont largement échoué, en partie parce que les mécanismes que les cellules utilisent pour interagir avec les fibres protéiques qui les entourent ne sont pas clairs, " a déclaré Shakiba. "Nous avons constaté que les fibroblastes utilisent des mécanismes complètement différents dans les premières étapes - et je pense les plus traitables - de ces interactions, et que leurs réponses aux drogues peuvent donc être à l'opposé de ce qu'elles seraient dans les stades ultérieurs."
Genin, qui est le co-directeur du CEMB, a déclaré que le processus a bloqué les chercheurs en mécanobiologie pendant un certain temps.
"Les chercheurs dans le domaine de la mécanobiologie pensaient que les cellules extrayaient le collagène de la matrice extracellulaire en tendant la main avec de longues protubérances, le saisir et le tirer en arrière, " dit Genin. "Nous avons découvert que ce n'était pas le cas. Une cellule doit d'abord se frayer un chemin à travers le collagène, alors au lieu de s'accrocher, il tire essentiellement de minuscules poils, ou filopodes, des côtés de ses bras, attire le collagène de cette façon, puis se rétracte."
Maintenant qu'ils comprennent ce processus, Genin a dit, ils peuvent contrôler la forme que prend une cellule.
"Avec nos collègues du CEMB à l'Université de Pennsylvanie, nous avons pu valider certains modèles mathématiques pour passer par le processus d'ingénierie, et nous avons maintenant les règles de base que les cellules suivent, " a-t-il dit. " Nous pouvons maintenant commencer à concevoir des stimuli spécifiques pour diriger une cellule à se comporter d'une certaine manière dans la construction d'une structure d'ingénierie tissulaire. "
Les chercheurs ont appris qu'ils pouvaient contrôler la forme des cellules de deux manières :en contrôlant les frontières qui l'entourent, et deuxieme, en inhibant ou en régulant positivement des protéines particulières impliquées dans le remodelage du collagène.
Les fibroblastes rapprochent les bords d'une plaie, l'amenant à se contracter ou à se fermer. Le collagène dans les cellules remodèle ensuite la matrice extracellulaire pour fermer complètement la plaie. C'est là qu'intervient la mécanobiologie.
"Il y a un équilibre entre la tension et la compression à l'intérieur d'une cellule qui est nouvellement exposée à des protéines fibreuses, " dit Genin. " Il y a de la tension dans les câbles d'actine, et en jouant avec cet équilibre, nous pouvons faire croître ces protubérances extrêmement longues, " a déclaré Genin. "Nous pouvons empêcher le remodelage de se produire ou nous pouvons l'augmenter."
L'équipe a utilisé une technique de cartographie 3-D - la première fois qu'elle a été appliquée au collagène - ainsi qu'un modèle informatique pour calculer les champs de contrainte et de contrainte 3-D créés par les protubérances des cellules. Au fur et à mesure que les cellules accumulent du collagène, le remodelage sous tension et l'alignement des fibres de collagène ont conduit à la formation de faisceaux de collagène. Cela nécessite des interactions coopératives entre les cellules, à travers lequel les cellules peuvent interagir mécaniquement.
"De nouvelles méthodes de microscopie, l'ingénierie tissulaire et la modélisation biomécanique améliorent considérablement notre compréhension des mécanismes par lesquels les cellules modifient et réparent les tissus qu'elles peuplent, " Elson a déclaré. "Les structures cellulaires fibreuses génèrent et guident des forces qui compriment et réorientent leur environnement fibreux extracellulaire. Cela soulève de nouvelles questions sur les mécanismes moléculaires de ces fonctions et comment les cellules régulent les forces qu'elles exercent et comment elles régissent l'étendue de la déformation de la matrice."
"La cicatrisation des plaies est un excellent exemple de la façon dont ces processus sont importants d'un point de vue physiologique, " a déclaré Genin. " Nous serons en mesure de trouver un moyen d'entraîner les cellules à ne pas trop compacter le collagène qui les entoure. "