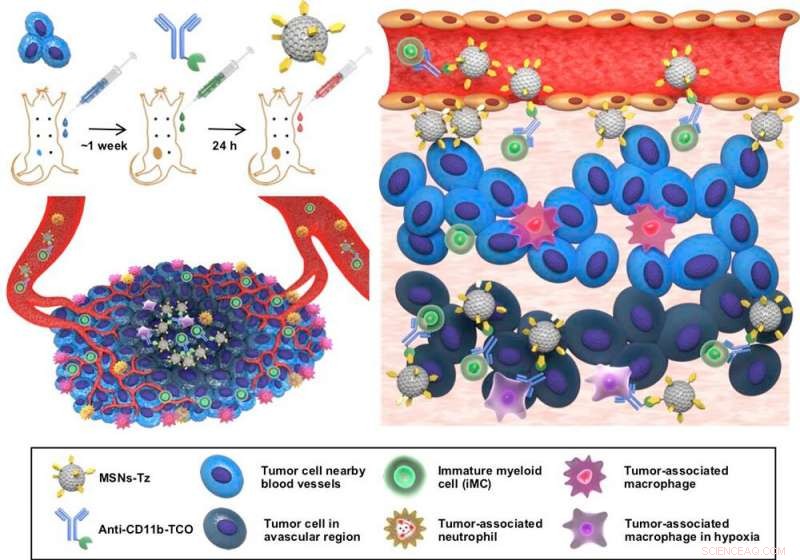
Figure 1 :Une représentation schématique de la stratégie de ciblage des cellules immunitaires assistée par réaction au clic (CRAIT) utilisée pour améliorer la pénétration tumorale des NP chargées de médicaments. (la gauche, haut) Les anticorps sont pré-injectés pour marquer les cellules immunitaires circulantes, et des nanoparticules chargées de médicament sont ensuite administrées pour cibler les cellules immunitaires via une réaction de clic. (la gauche, bas) Illustration schématique du microenvironnement tumoral caractérisé par le recrutement de cellules inflammatoires et la distribution inhomogène des vaisseaux sanguins. (à droite) Illustration schématique des principes de la stratégie du CRAIT. Les cellules immunitaires sont marquées par des anticorps et ensuite marquées avec des nanoparticules par une réaction de clic. Les cellules marquées transportent les nanoparticules de la périphérie de la tumeur à l'intérieur de la tumeur. Crédit :IBS
Les scientifiques de l'IBS ont signalé une nouvelle stratégie de ciblage qui permet une pénétration tumorale profonde des nanoparticules chargées de médicament. Ils ont induit la liaison d'anticorps ciblant les cellules immunitaires à des nanoparticules chargées de médicament sur les cellules, au lieu de les reprendre dans les cellules ou d'utiliser des conjugués anticorps-nanoparticules.
De minuscules nanobots circulant dans le corps pour réparer les cellules endommagées. Autrefois censée être considérée comme de la science-fiction, ces microrobots deviennent une réalité avec une multitude d'essais expérimentaux. On pense généralement que les nanoparticules sont si petites qu'elles peuvent se déplacer librement dans tout le corps après l'administration. Cependant, Ceci n'est que partiellement vrai. Dans une tumeur, les nanoparticules ne peuvent pénétrer dans les tumeurs qu'à une profondeur de 100 µm des vaisseaux. La diffusion des nanoparticules peut également être entravée par plusieurs barrières, tels que le tissu tumoral dense, pression interstitielle élevée, et distribution vasculaire inhomogène. Ainsi, les cellules cancéreuses situées en profondeur dans les tissus peuvent survivre, entraînant une récidive.
De façon intéressante, il est rapporté que les cellules immunitaires ont tendance à s'accumuler dans les tumeurs profondes. À mesure que les tumeurs dépassent l'approvisionnement en sang, les cellules immunitaires sont préférentiellement recrutées dans un microenvironnement tumoral pour soutenir l'apport sanguin aux tumeurs et le remodelage des tissus. Il y a eu plusieurs tentatives d'utiliser des cellules immunitaires pour délivrer des médicaments anticancéreux dans les régions inaccessibles par les approches de ciblage conventionnelles. Comme la plupart d'entre eux nécessitent des manipulations longues à extraire, grandir, et injecter des cellules, ce processus ex vivo diminue l'efficacité du traitement. D'autres ont exploré des moyens de faire en sorte que les anticorps porteurs de nanoparticules ciblent les cellules immunitaires. De nouveau, cette approche s'avère inefficace car les nanoparticules s'accumulent avec le médicament de chimiothérapie transporté et ne peuvent pas atteindre les désignations de manière efficace.
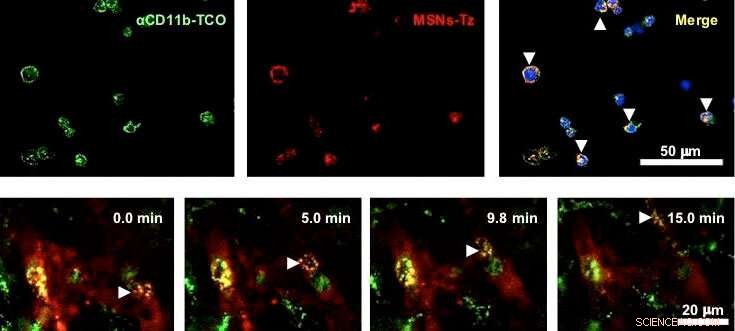
Figure 2 :(en haut) Évaluation in vitro de la réaction de clic entre les anticorps (vert) et les nanoparticules (rouge) sur les cellules immunitaires. (en bas) Les cellules immunitaires transportant des nanoparticules migrent dans les vaisseaux sanguins. Les flèches blanches indiquent les cellules immunitaires jaunes car elles sont marquées à la fois par des anticorps (vert) et des nanoparticules (rouge). Crédit :IBS
Dans un article publié en Journal de l'American Chemical Society , l'équipe de recherche conjointe dirigée par le directeur Taeghwan Hyeon au Center for Nanoparticles au sein de l'Institute for Basic Science (IBS) à Daejeon, Dr. Seung-Hae Kwon du Korea Basic Science Institute à Séoul, et le professeur Nohyun Lee de l'Université Kookmin de Séoul, La Corée du Sud a signalé une nouvelle stratégie de ciblage qui permet une pénétration tumorale profonde de nanoparticules chargées de médicament. Ils ont utilisé une "réaction au clic, " une réaction chimique qui relie facilement les blocs de construction moléculaires tout comme deux morceaux d'une ceinture de sécurité " cliquent " pour se boucler. " Notre idée était d'induire la liaison d'anticorps ciblant les cellules immunitaires à des nanoparticules chargées de médicaments sur les cellules, au lieu de les reprendre dans les cellules ou d'utiliser des conjugués anticorps-nanoparticules. La plupart des autres études l'ont fait et n'ont pas produit de résultats satisfaisants, " note le professeur Nohyun Lee, l'auteur correspondant de l'étude.
Dans une réaction de clic, les réactifs chimiques permettent un lien facile des groupes chimiques non naturels à n'importe quel site d'une protéine cible avec une sélectivité élevée pour le site. Dans l'étude, les chercheurs ont utilisé la réaction de clic entre le trans-cyclooctène et la tétrazine. Des anticorps fonctionnalisés par le trans-cyclooctène sont injectés à des souris pour marquer les cellules immunitaires infiltrant la tumeur. Au bout d'un certain temps, Des nanoparticules de silice mésoporeuse fonctionnalisées par la tétrazine sont administrées de sorte qu'elles « cliquent » pour se lier aux cellules immunitaires. « Cette stratégie de ciblage des cellules immunitaires assisté par réaction au clic (CRAIT) a réussi à « envahir » les zones visées :l'imagerie par fluorescence en temps réel du tissu tumoral montre que les cellules immunitaires mobiles transportent les nanoparticules, comme le montre la figure 2. la méthode CRAIT a permis de doubler la charge tumorale dans les modèles agressifs de cancer du sein, " explique le Dr Soo Hong Lee, le premier auteur de l'étude. Les nanoparticules chargées d'un médicament anticancéreux, doxorubicine, n'a pas affecté la viabilité et la migration des cellules.
Directeur Taeghwan Hyeon, l'auteur correspondant de l'étude dit, "La distribution intratumorale des nanoparticules délivrées par la méthode CRAIT a été la clé pour surmonter les limitations des méthodes de livraison conventionnelles. Cette étude élargira l'application des nanomédicaments."
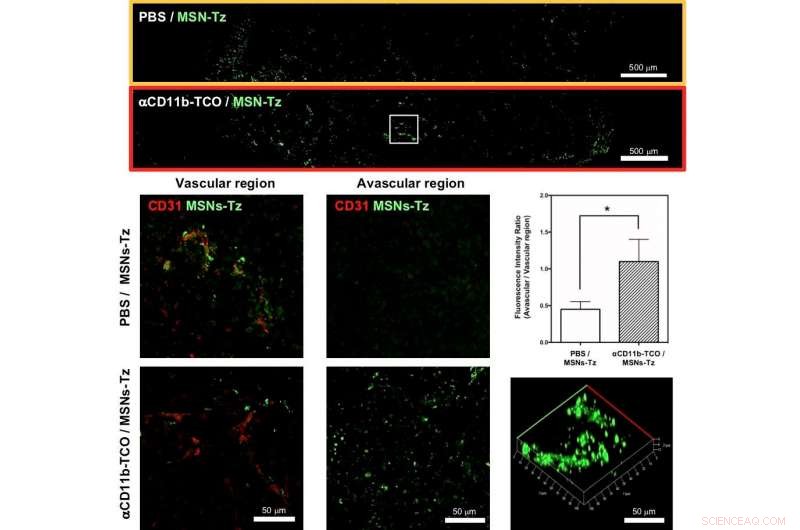
Figure 3 :(en haut) Sections de tumeurs représentatives sélectionnées pour montrer la distribution des nanoparticules dans le groupe non ciblé (boîte orange) et le groupe CRAIT (boîte rouge). (milieu et bas, gauche et milieu) Distribution intratumorale du groupe non ciblé (milieu) et du groupe CRAIT (bas) dans la région vasculaire (gauche) et la région avasculaire (milieu). (droit, milieu) Ratio entre vasculaire et région du groupe non ciblé et du groupe CRAIT. (droit, en bas) Image de microscopie tridimensionnelle de la coupe tumorale. Crédit :IBS
La méthode CRAIT reposant sur la réaction au clic, il peut être appliqué à divers véhicules de livraison dont les micelles, liposomes, et d'autres nanoparticules. En outre, si des anticorps adéquats sont disponibles, diverses cellules circulantes peuvent être utilisées comme véhicules d'administration. Parce que les cellules circulantes sont impliquées dans diverses maladies inflammatoires, la couverture de la méthode CRAIT ne se limite pas au cancer. La méthode polyvalente CRAIT est simple, ce qui nécessite la modification des anticorps et des nanoparticules en utilisant une réaction de bio-conjugaison bien développée.