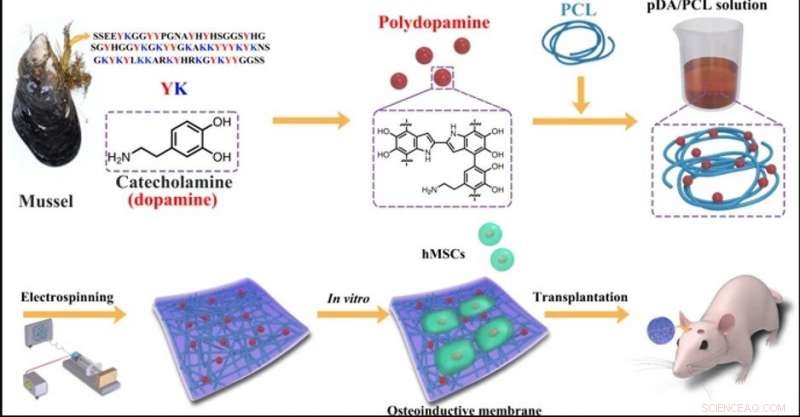
Dessin schématique de la fabrication des membranes conçues par électrofilage de PCL et PDA NPs. Crédit :NPG Asia Materials, doi:10.1038/s41427-019-0139-5
Dans une nouvelle étude maintenant publiée sur NPG Asie Matériaux , les bio-ingénieurs rapportent le développement d'une nouvelle membrane fibreuse avec des cellules souches pour réparer les défauts osseux dans les crânes de souris. Pour ça, ils ont incorporé la protéine polydopamine inspirée des moules en tant que composé prometteur pour attacher des substances biologiques aux surfaces membranaires, un peu comme les protéines adhésives dans les moules. Dans le travail, Yi Deng et une équipe de recherche dans les départements interdisciplinaires de génie chimique, génie mécanique, technologie des matériaux, centre des matériaux du futur et de la médecine régénérative en Chine et en Australie, revêtu les membranes biocompatibles de nanoparticules de polydopamine pour former de nombreux sites topologiques pour la fixation du calcium et la réparation des défauts osseux.
L'équipe a incubé les membranes non revêtues et revêtues avec des cellules souches isolées de la moelle osseuse et a implanté les membranes pour régénérer les défauts de l'os du crâne chez des souris vivantes. Après une étude translationnelle de 2 mois, ils ont révélé la capacité des membranes collantes à diriger les cellules souches pour produire des quantités significativement plus élevées d'os, par rapport aux membranes non revêtues. Les défauts osseux et les blessures peuvent généralement survenir au niveau microscopique sous forme de malformations congénitales, en raison d'accidents ou d'une maladie dégénérative liée à l'âge. La plupart des défauts osseux ne peuvent pas être réparés spontanément par des mécanismes d'auto-guérison, ce qui conduit à un besoin urgent de développer des biomatériaux robustes qui facilitent la réparation osseuse dans la recherche osseuse et l'ingénierie du tissu osseux.
Les bio-ingénieurs peuvent manipuler la différenciation des cellules souches pour former des ostéoblastes matures via la régénération tissulaire guidée (GTR) sur les membranes de surface pour optimiser, régénération osseuse à grande échelle. En science des matériaux et matériaux fonctionnels avancés, les membranes électrofilées ont reçu une attention massive pour de telles stratégies d'ingénierie tissulaire guidées en raison de plusieurs avantages biocompatibles, comprenant:
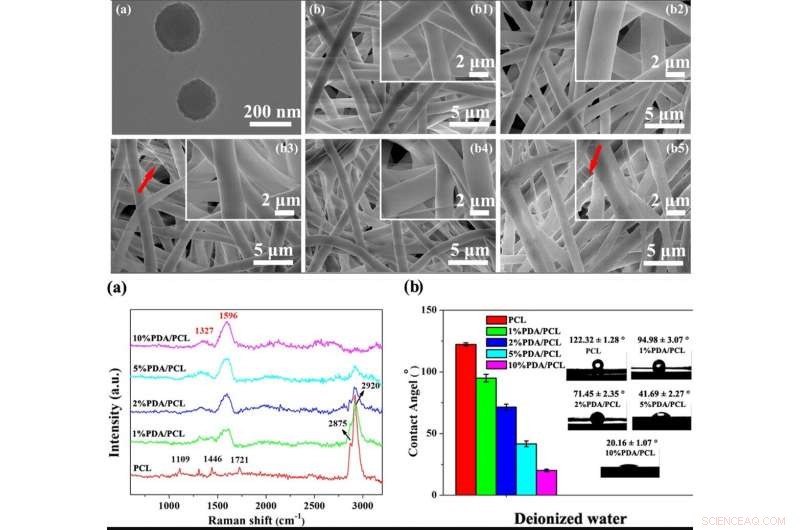
EN HAUT :Micro-morphologies des NPs PDA et des membranes fibreuses PDA/PCL électrofilées. une image MET de PDA NPs; b Images SEM du (b1) PCL vierge, (b2) 1% PDA/PCL, (b3) 2% PDA/PCL, (b4) 5% PDA/PCL, et (b5) 10 % de membranes fibreuses PDA/PCL. Les flèches rouges en b pointent vers les filaments. EN BAS :Constituants chimiques des membranes fibreuses PDA/PCL. (a) spectres Raman et (b) angles de contact avec les images de gouttelettes d'eau correspondantes des membranes fibreuses PDA/PCL. Crédit :NPG Asia Materials, doi:10.1038/s41427-019-0139-5
Les scientifiques des matériaux classent les matériaux synthétiques GTR en deux catégories principales :(1) les matériaux bioabsorbables et (2) les matériaux non absorbables; où les matériaux non résorbables doivent être retirés après implantation via une seconde intervention chirurgicale, entraînant une augmentation des dépenses de santé, tout en compromettant les tissus nouvellement générés. En revanche, des membranes biodégradables telles que l'alcool polyvinylique (PVA), poly (lactide-co-glycolide) (PLGA) ou PCL sont préférés pour les implantations cliniques, bien que des complications biologiques aient sérieusement entravé leur adoption clinique.
Dans le travail present, donc, Deng et al. utilisé la protéine adhésive bioinspirée sécrétée par les moules comme revêtement de surface « indépendant du matériau » et facile, stratégie d'ingénierie basée sur la chimie du catéchol. La polydopamine (PDA) peut faciliter la différenciation ostéoblastique des cellules souches sur une variété de substrats en tant que revêtement de biomatériaux à l'échelle nanométrique, pour soutenir la fixation des cellules souches mésenchymateuses et induire la reprogrammation des cellules somatiques humaines. Néanmoins, Les nanocouches de PDA peuvent facilement se décoller des surfaces pour induire une apoptose cellulaire locale ou des réactions inflammatoires en tant qu'effets indésirables. Deng et al. mis en œuvre des étapes expérimentales spécifiques pour surmonter les limitations existantes et développer une nouvelle membrane biocompatible et biodégradable en laboratoire. Le biomatériau ou la membrane fibreuse nouvellement conçu fournira une niche favorable pour orienter le destin des cellules souches locales afin de former des ostéoblastes pour la régénération osseuse.
Première étape :Ingénierie du PCL inclus dans le PDA (PDA/PCL) avec électrofilage
Les scientifiques ont utilisé la chimie du catéchol pour la fabrication et la synthèse des membranes fibreuses PDA/PCL. Ils ont uniformément dispersé les nanoparticules (NP) de PDA dans le PCL via une sonication continue et un vortex pour former les membranes fibreuses par électrofilage. Deng et al. utilisé un microscope électronique à balayage (MEB) et observé les propriétés de surface de l'aléatoire, réseau fibreux de la taille d'un micron. Relativement, les membranes électrofilées PCL pures sont restées lisses, alors que l'intégration des PDA NPs a rendu les surfaces des fibres rugueuses. Les scientifiques ont confirmé la nouvelle chimie de surface à l'aide des spectres Raman et de l'analyse par spectroscopie photoélectronique à rayons X (XPS). Les biomatériaux étaient hydrophiles permettant l'adsorption des protéines et l'attachement cellulaire. Les chercheurs ont effectué des mesures d'angle de contact pour vérifier la mouillabilité de la surface et l'amélioration de l'hydrophilie après modification du PDA par rapport au pur, membranes PCL non modifiées.
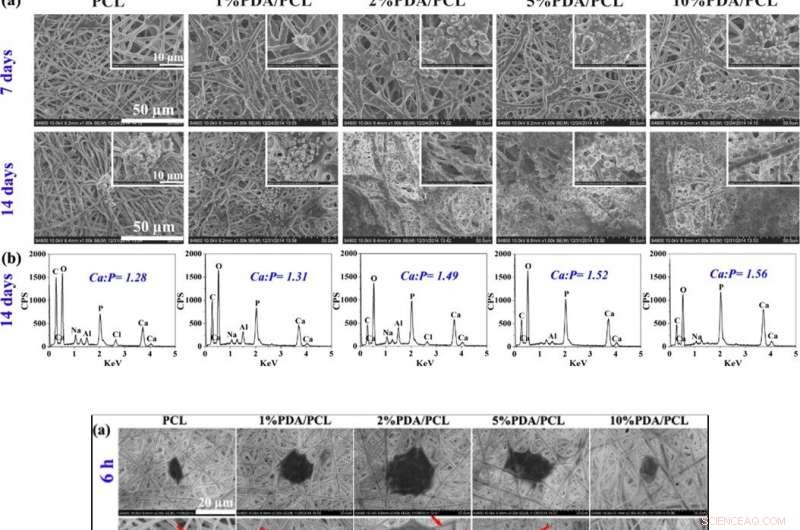
EN HAUT :Formation de nodules osseux. (a) Photographies SEM de membranes fibreuses PDA/PCL acquises après trempage dans du SBF pendant 7 et 14 jours. (b) Données EDS et rapports Ca/P des sédiments de particules à la surface des membranes fibreuses PDA/PCL à 14 jours. EN BAS :Attachement et prolifération cellulaires. (a) Observation SEM et b CLSM des hMSCs adhérentes sur les membranes fibreuses modifiées avec différentes concentrations de PDA NP à 6 et 12 h. Les flèches rouges pointent vers les pseudopodes. Les encarts en haut à droite de (b) montrent les images agrandies d'une seule cellule. (c) attachement cellulaire et (d) courbes de prolifération des hMSCs sur les surfaces des échantillons obtenus via CCK-8. * Représente p < 0,05 entre les groupes, ** représente p < 0,01 entre les groupes ; et # représente p < 0,05 par rapport aux autres groupes. Crédit :NPG Asia Materials, doi:10.1038/s41427-019-0139-5
Deuxième étape :Études de caractérisation de surface
Étant donné que les membranes bioactives peuvent s'intégrer au tissu osseux environnant (tissu osseux), Deng et al. ont évalué la formation de couches d'apatite osseuse à la surface de biomatériaux immergés dans une solution de fluide corporel simulé (SBF). Après 7 jours d'immersion, les scientifiques ont observé des agrégats nodulaires groupés sur les membranes PDA/PCL, qui a augmenté de façon spectaculaire au jour 14. En comparaison, l'échantillon témoin de PCL vierge non modifié a retenu les dépôts de Ca-P à sept jours, avec des îles d'apatite au jour 14. Au fur et à mesure que le contenu du PDA augmentait, donc, la quantité d'apatite déposée à la surface augmente. Deng et al. ont utilisé les données de caractérisation des matériaux pour valider l'amélioration de la bioactivité in vitro des membranes PDA/PCL par rapport au contrôle PCL pur.
Troisième étape :Études de biofonctionnalisation
Les scientifiques ont évalué la cytocompatibilité (biocompatibilité cellulaire) des membranes PDA/PCL modifiées par rapport à l'adhésion cellulaire, diffusion, et la prolifération des cellules souches mésenchymateuses humaines (hMSCs). Les hMSCs existent en grande partie dans la moelle osseuse pour aider à la réparation des tissus lors d'une blessure. Après 6 heures de culture cellulaire, les hMSCs avec des formes cellulaires rondes n'adhèrent pas bien sur PCL pur mais exprimaient des filopodes pour la fixation à la surface membranaire sur trois variantes de membranes PDA/PCL. À l'aide d'expériences de comptage cellulaire et de tests de viabilité cellulaire CCK-8, Deng et al. ont montré que le contenu des NP de PDA affectait significativement le nombre de cellules viables attachées à la surface, et observé des propriétés de surface optimales avec le groupe PDA/PCL à 2 pour cent dans le travail.
L'équipe de recherche a déterminé la formule optimale pour concevoir des membranes PDA/PCL pour la régénération guidée du tissu osseux en déterminant l'activité de la phosphatase alcaline (ALP) et la production de matrice calcique des hMSC avec la coloration Alizarin Red S (ARS). La croissance cellulaire et la différenciation ostéogénique étaient faibles lorsque les quantités de NP PDA étaient élevées ou faibles, parce que de faibles concentrations n'ont pas déclenché la croissance cellulaire, alors que des concentrations élevées étaient toxiques dans l'étude.
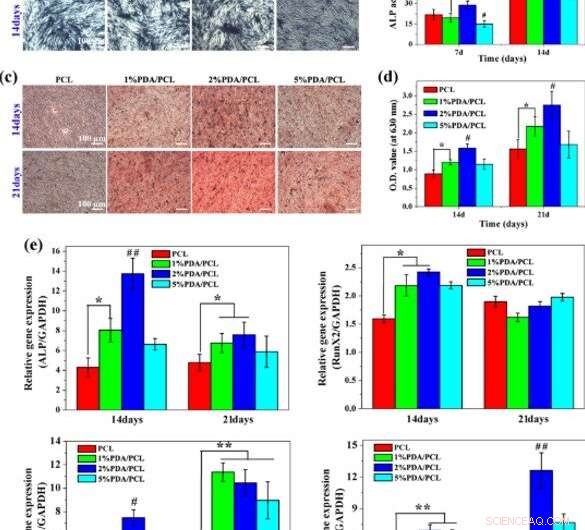
Différenciation ostéogénique :a, b Coloration et quantification de l'activité ALP, c, d Coloration ARS et quantification de la production de calcium, et e analyse RT-PCR des gènes ostéo-spécifiques sur différentes membranes fibreuses PDA/PCL. * représente p < 0,05 entre les groupes, **représente p < 0,01 entre les groupes. # représente p < 0,05 par rapport aux autres groupes, et ## représente p < 0,05 par rapport aux autres groupes. Crédit :NPG Asia Materials, doi:10.1038/s41427-019-0139-5
Puisque les investigations au niveau moléculaire sont un outil puissant dans les biomatériaux pour la bio-ingénierie, Deng et al. ont étudié l'interaction entre les hMSCs et les membranes artificielles à l'aide d'outils moléculaires. Pour ça, ils ont suivi l'expression des gènes ALP liés à l'ostéogenèse, Runx2, Col1a1 et OPN dans les hMSC cultivées sur les membranes. A 7 jours, ils ont observé des niveaux substantiels d'expression du gène ALP sur l'échantillon PDA/PCL à 2 pour cent.
Au jour 14, le niveau de gène Runx2 exprimé sur 1 et 2 pour cent des groupes PDA/PCL dépassait significativement le groupe PCL pur. Cependant, de 21 jours, les scientifiques n'ont pas observé de différence discernable entre les quatre groupes. Ils ont vérifié les observations en utilisant la coloration par immunofluorescence et ont choisi les membranes PDA/PCL à 2 pour cent pour une induction optimale des hMSCs pour se différencier en ostéoblastes matures.
Quatrième étape :étude translationnelle
Guidé par les données d'expériences in vitro, Deng et al. ont étudié la biofonctionnalité in vivo de la membrane microfibre à l'aide d'un modèle animal. Pour ça, ils ont créé des défauts osseux de taille critique sur des crânes de souris et placé des membranes fibreuses pour couvrir les défauts, suivis de tests de formation osseuse par micro-tomodensitométrie (micro-CT), analyses histologiques et marquage fluorescent; quatre à huit semaines après l'implantation.
Lorsqu'ils ont examiné les images 3D des crânes micro-CT, la membrane PDA/PCL à 2 % offrait les plus grandes zones de formation osseuse nouvelle, avec une expansion considérable au centre du défaut osseux. Les scientifiques ont obtenu une teneur plus élevée en matrice calcifiée et en remodelage osseux dans les 2 % des membranes PDA/PCL pour une intégration ostéoconductrice phénoménale.
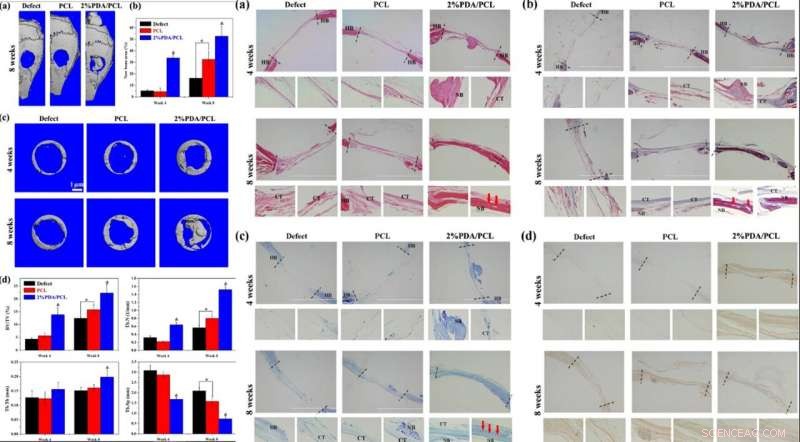
GAUCHE :Évaluation in vivo des membranes fibreuses PDA/PCL. (a) Images micro-CT 3D reconstruites de crânes entiers après la chirurgie à 8 semaines. (b) Quantification de nouvelles zones osseuses à 4 et 8 semaines. (c) Images micro-CT des défauts et d histomorphométrie osseuse des implants membranaires analysés à partir des données micro-CT après 4 et 8 semaines. * représente p < 0,05 entre les groupes, et &représente p < 0,05 par rapport aux autres groupes. À DROITE :Analyse histologique et immunohistologique Analyse histologique et immunohistologique des coupes pour les défauts calvariaux uniquement et les défauts implantés avec des membranes fibreuses PCL et 2 % PDA/PCL à 4 et 8 semaines après l'implantation :(a) coloration H&E, (b) coloration de Masson, (c) coloration au bleu de toluidine, (d) et coloration immunohistologique de l'OCN. os hôte HB; TDM tissu conjonctif ; NB os nouvellement formé. Les flèches rouges dans a–c pointent vers le vaisseau sanguin. Crédit :NPG Asia Materials, doi:10.1038/s41427-019-0139-5
La coloration à l'hématoxyline et à l'éosine (H&E) a révélé du tissu fibreux dans les cavités du groupe PCL, avec une restructuration osseuse relativement visible dans le groupe PDA/PCL à 2 pour cent. Les scientifiques ont également observé des os avec une vascularisation abondante après 8 semaines après l'opération dans les groupes PDA/PCL à 2 %. Ils ont effectué une coloration supplémentaire avec Masson, coloration au bleu de toluidine et immunohistochimie (IHC) pour identifier en profondeur la nouvelle formation osseuse et de collagène. Les données histologiques combinées ont révélé que l'emploi des NP de PDA dans des membranes fibreuses modifiées stimulait considérablement la régénération osseuse, soutenant l'hypothèse que l'ostéodifférenciation in vitro était également efficace in vivo.
De cette façon, Yi Deng et ses collègues ont conçu des PDA co-électrofilés par bio-ingénierie avec un polymère synthétique bioinerte pour construire bioinspiré, Membranes fibreuses PDA/PCL flexibles et ostéopromotrices pour les applications d'ingénierie tissulaire osseuse en médecine régénérative. La quantité de NP PDA incluse dans le composite a considérablement amélioré la composition chimique, la taille des fibres et les propriétés mécaniques des membranes développées. Les expériences in vitro et les données in vivo ont validé la capacité de formation de nouveaux os avec 2 % de constructions PDA/PCL par rapport à la PCL pure. Les membranes PCL/PDA conçues sont ostéoconductrices et faciles à transplanter avec un grand potentiel pour les applications GTR.
© 2019 Réseau Science X