Crédit :Wiley
Nanocapsules biocompatibles, chargé d'un acide aminé et équipé d'une enzyme combine maintenant deux stratégies anti-tumorales dans un concept de traitement synergique. Les chercheurs espèrent que cela augmente l'efficacité et diminue les effets secondaires. Dans la revue Angewandte Chemie , les scientifiques expliquent le concept :les cellules tumorales sont privées de leur glucose nutritif car celui-ci est converti en monoxyde d'azote (NO) et en peroxyde d'hydrogène (H2O2) toxiques.
Le NO est un gaz toxique qui provoque le smog. Cependant, à de faibles concentrations dans le corps, c'est une molécule messagère importante qui régule des choses telles que la circulation et la libido. C'est aussi une arme de défense physiologique importante contre les champignons et les bactéries. À des concentrations plus élevées, Le NO est capable de tuer les cellules tumorales et d'augmenter l'efficacité des traitements photodynamiques et radiologiques. Pour usage clinique, NO doit être libéré dans la zone cible à partir d'un précurseur biocompatible.
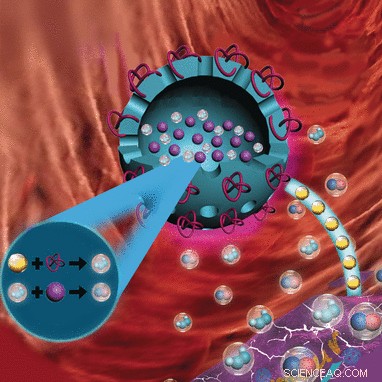
L'acide aminé naturel L-arginine (L-Arg) peut être utile dans un tel système, parce que l'enzyme native inductible NO synthase (iNOS) fabrique du NO à partir de L-Arg. NO est également formé lorsque L-Arg est oxydé par H2O2. Ceci est intéressant car le microenvironnement autour des tumeurs est riche en H2O2. Cette approche de la thérapie par les gaz NO est poursuivie par des chercheurs de l'Université de Shenzhen (Chine), les National Institutes of Health (Bethesda, ETATS-UNIS), et l'Université du Maryland (College Park, ETATS-UNIS). Leur particularité est de combiner cette thérapie par gaz avec une méthode pour affamer les cellules cancéreuses dans un traitement synergique.
Au lieu d'affamer une tumeur en bloquant les vaisseaux sanguins qui l'alimentent, les chercheurs ont l'intention d'éliminer le glucose dont la tumeur a besoin pour se nourrir en le consommant dans une réaction métabolique :l'enzyme glucose oxydase (GOx) convertit le glucose en acide gluconique et en H2O2. L'augmentation de la concentration en H2O2 est un effet secondaire utile, car H2O2 est à la fois cytotoxique et accélère la libération de NO de L-Arg. Un autre effet secondaire utile est que H2O2 et NO réagissent pour former des peroxynitrites hautement toxiques qui endommagent les cellules tumorales.
L'équipe de recherche dirigée par Peng Huang, Tianfu Wang, et Xiaoyuan Chen a maintenant atteint une étape importante dans le développement de ce concept. Ils ont développé des biocompatibles, biodégradable, nanocapsules poreuses constituées d'organosilicates qui transportent simultanément GOx et L-Arg dans les cellules tumorales. GOx est lié à la surface; L-Arg est stocké à l'intérieur de la capsule. Alors que le GOx est actif immédiatement après l'injection des nanocapsules dans la tumeur, L-Arg est libéré petit à petit, d'abord par les pores de la capsule, puis à mesure que la capsule se désintègre. Leur grande cavité permet également aux capsules de servir de matériau de contraste ultrasonore pour une meilleure localisation de la tumeur.
Des expériences avec des cultures cellulaires et des souris ont démontré l'effet synergique significatif de cette thérapie combinée, qui inhibe avec succès la croissance cellulaire, initie la mort cellulaire, et rétrécit les tumeurs chez la souris.