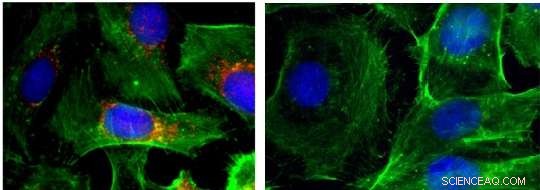
Images d'immunofluorescence des cellules (noyaux indiqués en bleu ; actine indiquée en vert ; BRAF indiqué en rouge). Contrôle gauche; à droite :après traitement avec des nanoparticules qui font taire BRAF. Crédit :Jinjun Shi, Hôpital Brigham et femmes
Cancer anaplasique de la thyroïde (ATC), la forme la plus agressive de cancer de la thyroïde, a un taux de mortalité de près de 100 pour cent et une durée de survie médiane de trois à cinq mois. Une stratégie prometteuse pour le traitement de ces tumeurs solides et d'autres est la nanotechnologie d'interférence ARN (ARNi), mais l'administration d'agents ARNi aux sites de tumeurs s'est avérée difficile. Les enquêteurs du Brigham and Women's Hospital, avec des collaborateurs du Massachusetts General Hospital, ont développé une nanoplateforme innovante qui leur permet de délivrer efficacement des agents ARNi aux sites du cancer et de supprimer la croissance tumorale et de réduire les métastases dans les modèles précliniques d'ATC. Leurs résultats paraissent cette semaine dans Actes de l'Académie nationale des sciences .
"Nous appelons cela une plate-forme 'théranostique' car elle rassemble une thérapie et un diagnostic dans une nanoparticule fonctionnelle, " a déclaré le co-auteur principal Jinjun Shi, Doctorat, professeur adjoint d'anesthésie au département d'anesthésie. "Nous nous attendons à ce que cette étude ouvre la voie au développement de plates-formes théranostiques pour la livraison d'ARNi guidée par l'image aux cancers avancés."
ARNi, dont la découverte a remporté le prix Nobel de physiologie ou médecine il y a 10 ans, permet aux chercheurs de faire taire les gènes mutés, y compris ceux dont dépendent les cancers pour se développer, survivre et se métastaser. De nombreux ATC dépendent de mutations dans le gène du cancer couramment muté BRAF. En délivrant des agents ARNi qui ciblent spécifiquement et font taire ce gène muté, les enquêteurs espéraient arrêter à la fois la croissance et la propagation de l'ATC, qui métastase souvent aux poumons et à d'autres organes.
Lorsque l'ARNi est délivré seul, il est généralement décomposé par des enzymes ou filtré par les reins avant d'atteindre les cellules tumorales. Même lorsque les agents ARNi parviennent jusqu'à la tumeur, ils sont souvent incapables de pénétrer ou sont rejetés par les cellules cancéreuses. Pour surmonter ces obstacles, les chercheurs ont utilisé des nanoparticules pour délivrer les molécules d'ARNi aux tumeurs ATC. En outre, ils ont couplé les nanoparticules avec un polymère fluorescent proche infrarouge, ce qui leur a permis de voir où les nanoparticules s'accumulaient dans un modèle murin d'ATC.
En mesurant la lueur du polymère fluorescent proche infrarouge, l'équipe a vérifié que les nanoparticules avaient atteint le site primaire de l'ATC dans la thyroïde. L'équipe a découvert que les nanoparticules circulaient pendant de longues périodes dans la circulation sanguine et s'accumulaient à des concentrations élevées dans les tumeurs.
En outre, l'équipe rapporte des preuves que BRAF a été réduite au silence avec succès sur ces sites. Ils ont trouvé que, pour les cellules cultivées en boîte et traitées avec les nanoparticules contenant des agents ARNi, la croissance cellulaire a été considérablement ralentie et le nombre de cellules cancéreuses capables de migrer a diminué jusqu'à 15 fois. Dans les modèles de souris, la croissance tumorale a également été ralentie et moins de métastases se sont formées.
Afin de traduire la nouvelle plateforme en applications cliniques, l'équipe de recherche note l'importance d'avoir un diagnostic d'imagerie qui leur permettra d'évaluer rapidement quels patients sont les plus susceptibles de bénéficier de la nanothérapie ARNi.
« La plupart des patients qui consultent des chirurgiens pour un cancer anaplasique de la thyroïde n'ont plus d'options et cette nouvelle recherche offre à ces patients quelques options. Avoir une approche qui nous permet de visualiser rapidement et de fournir simultanément une thérapie ciblée pourrait être essentiel pour le traitement efficace de cette maladie. et autres cancers mortels de mauvais pronostic, " a déclaré le co-auteur principal, Sareh Parangi, MARYLAND, professeur agrégé au département de chirurgie de l'HGM.