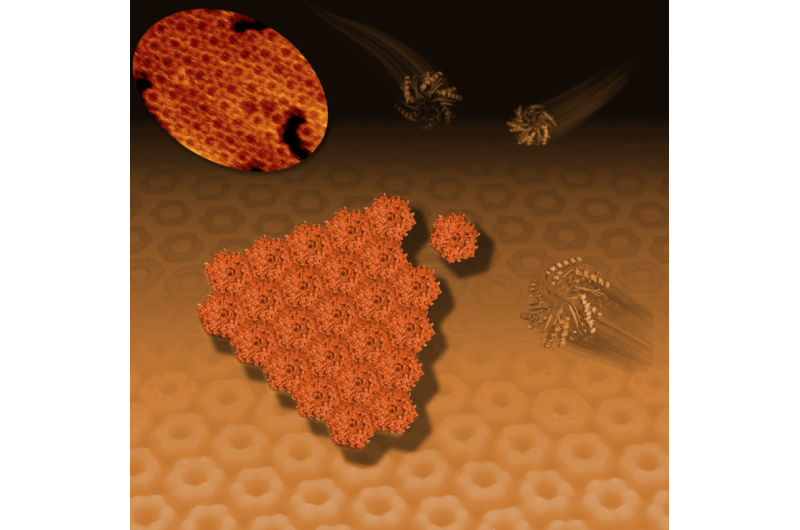
Cette illustration montre comment les protéines bactériennes hexagonales (présentées sous forme de structures en forme de ruban à droite et en haut à droite) s'auto-assemblent en un motif en mosaïque en nid d'abeille (centre et arrière-plan). Cette activité de carrelage, vu avec un microscope à résolution atomique (en haut à gauche), représente la formation précoce du polyèdre, structures ressemblant à des ballons de football connues sous le nom de microcompartiments bactériens ou BCM qui servent de minuscules usines pour une gamme d'activités spécialisées. Crédit :Berkeley Lab
Les scientifiques ont pour la première fois observé comment les protéines bactériennes s'auto-assemblent en feuilles minces et commencent à former les parois de l'enveloppe extérieure pour des compartiments polyédriques de taille nanométrique qui fonctionnent comme des usines spécialisées.
La recherche, dirigé par des chercheurs du Lawrence Berkeley National Laboratory (Berkeley Lab) du département américain de l'Énergie et de la Michigan State University en collaboration avec l'Université de Liverpool, fournit de nouveaux indices pour les scientifiques cherchant à utiliser ces structures 3-D comme « nanoréacteurs » pour aspirer sélectivement les toxines ou produire les produits souhaités.
La nouvelle idée peut aider les scientifiques qui cherchent à exploiter cet origami naturel en concevant de nouveaux compartiments ou en les utilisant comme échafaudage pour de nouveaux types d'architectures à l'échelle nanométrique, tels que les systèmes de distribution de médicaments.
"Nous avons un nouvel indice pour comprendre l'architecture des cellules internes de la nature, " a déclaré Cheryl Kerfeld, un biologiste structural de Berkeley Lab qui est co-auteur de l'étude. Son groupe de recherche au Berkeley Lab est spécialisé dans la structure et le fonctionnement interne de ces minuscules compartiments, connus sous le nom de microcompartiments bactériens ou BMC. Kerfeld occupe des postes conjoints avec la division de biophysique moléculaire et de bioimagerie intégrée (MBIB) de Berkeley Lab et la Michigan State University.
"Nous ne voyons généralement ces structures qu'après leur formation, mais dans ce cas, nous les regardons s'assembler et répondons à quelques questions sur leur formation, " a déclaré Kerfeld. " C'est la première fois que quelqu'un visualise l'auto-assemblage des facettes, ou côtés, des microcompartiments. C'est comme voir des murs, composé de tuiles de forme hexagonale, construit par des mains invisibles."
L'étude a été publiée en ligne le 30 novembre dans Lettres nano .
Plusieurs modèles avaient été proposés sur la façon dont ces compartiments sont construits de toutes pièces à l'intérieur des bactéries par des protéines, et il y avait beaucoup de questions ouvertes sur le processus de construction.
Les chercheurs ont combiné des études aux rayons X de la structure 3-D d'une protéine qui ressemble à un hexagone avec une imagerie par un microscope à force atomique pour révéler comment les hexagones s'organisent en nid d'abeilles dans les parois du microcompartiment.
Markus Sutter, un scientifique de Berkeley Lab qui est l'auteur principal de l'étude, déterminé la structure 3-D de la protéine de base à la source lumineuse avancée du laboratoire de Berkeley à l'aide d'échantillons cristallisés. Les motifs produits lorsque les rayons X ont frappé les cristaux de protéine ont fourni des détails clés sur la forme de la protéine, à l'échelle des atomes individuels. "Cela nous a donné des dimensions exactes, " Sutter a dit, qui a aidé à interpréter les images du microscope. « Cela nous a également montré que les hexagones avaient des côtés distincts :un côté est concave, l'autre côté est convexe."
Le microscope à force atomique de Liverpool, BioAFM, ont montré que des morceaux de protéines individuels en forme d'hexagone se rejoignent naturellement pour former des feuilles de protéines de plus en plus grandes dans une solution liquide. Les hexagones ne s'assemblaient entre eux que s'ils avaient la même orientation :convexe avec convexe ou concave avec concave.
"D'une manière ou d'une autre, ils s'assurent sélectivement qu'ils finissent par faire face de la même manière, " ajouta Kerfeld.
L'étude a également révélé que des morceaux individuels en forme d'hexagone de la feuille de protéines peuvent se déloger et passer d'une feuille de protéines à une autre. Une telle dynamique peut permettre à des compartiments entièrement formés de réparer des côtés individuels.

Markus Sutter, un scientifique du Berkeley Lab, déterminé la structure atomique 3-D d'une protéine bactérienne qui s'auto-assemble en feuilles à motifs en nid d'abeilles à l'aide de rayons X sur la ligne de lumière 5.0.1 (illustrée ici) à la source de lumière avancée de Berkeley Lab. Crédit :Roy Kaltschmidt/Laboratoire de Berkeley
Les feuillets protéiques étudiés n'ont pas été visualisés à l'intérieur de bactéries vivantes, bien que les conditions de l'expérience au microscope aient été conçues pour imiter celles de l'environnement bactérien naturel. "Nous pensons que c'est ce qui se passe lorsque ces compartiments s'assemblent à l'intérieur du microbe, ", a déclaré Kerfeld.
Certaines études ont proposé que l'enveloppe protéique des microcompartiments pourrait avoir plusieurs couches d'épaisseur. Cependant, cette étude suggère que les facettes de la coquille sont composées d'une seule couche de protéines. Sutter a déclaré que cela avait du sens :les compartiments sont connus pour permettre sélectivement certains échanges chimiques entre leur contenu et leur environnement extérieur, et une coque plus épaisse pourrait compliquer ces échanges.
Le mécanisme exact de cet échange chimique n'est pas encore bien compris. Ceci et d'autres mystères des microcompartiments peuvent, espérons-le, être résolus avec des études de suivi qui cherchent à faire la chronique du processus d'assemblage complet, les chercheurs ont dit.
Les microcompartiments 3-D entièrement formés ont une géométrie semblable à un ballon de football qui incorpore des structures de protéines en forme de pentagone connues sous le nom de pentamères, par exemple, qui n'ont pas été inclus dans la dernière étude.
"Le Saint Graal est de voir la structure et la dynamique d'une coquille intacte, composé de plusieurs types différents de protéines hexagonales et avec les pentagones qui coiffent ses coins, ", a déclaré Kerfeld.
Il est possible que le simple ajout de ces pentamères aux feuilles de protéines de la dernière expérience puisse stimuler la croissance d'une structure 3-D complète, mais Kerfeld a ajouté, "Je ne serais pas surpris s'il y avait plus dans l'histoire."
Une fois de plus appris sur les microcompartiments, il est concevable qu'ils puissent être utilisés pour concentrer la production d'enzymes bénéfiques, les organiser pour produire une séquence ordonnée de réactions chimiques, ou pour éliminer des toxines particulières du milieu environnant, elle a dit.