
De nombreuses bactéries et archées s'enferment dans une enveloppe protectrice auto-assemblée de protéines de la couche S, comme une armure en cotte de mailles. Le procédé est un modèle pour l'auto-assemblage de nanostructures organiques et inorganiques 2D et 3D.
Imaginez des milliers de copies d'une seule protéine organisée en une cotte de mailles qui protège le porteur des conditions environnementales difficiles et en constante évolution. C'est le cas de nombreux micro-organismes. Dans une nouvelle étude, des chercheurs du Lawrence Berkeley National Laboratory (Berkeley Lab) du département américain de l'Énergie (DOE) ont découvert des détails clés de ce processus naturel qui peuvent être utilisés pour l'auto-assemblage de nanomatériaux en structures complexes bidimensionnelles et tridimensionnelles.
Caroline Ajo-Franklin, un chimiste et biologiste synthétique à la fonderie moléculaire de Berkeley Lab, a dirigé cette étude dans laquelle des mesures de diffusion de la lumière à haut débit ont été utilisées pour étudier l'auto-assemblage de nanofeuillets 2D à partir d'une protéine de couche de surface bactérienne commune (couche S). Cette protéine, appelé "SbpA, " forme l'armure protectrice de Lysinibacillus sphaericus, une bactérie du sol utilisée comme toxine pour lutter contre les moustiques. Leur enquête a révélé que les ions calcium jouent un rôle clé dans la façon dont cette armure s'assemble. Deux rôles clés en fait.
"Les ions calcium déclenchent non seulement le repliement de la protéine dans la forme correcte pour la formation de nanofeuillets, mais aussi servir à lier les nanofeuillets entre eux, " Ajo-Franklin dit. " En établissant et en utilisant la diffusion de la lumière comme proxy pour la formation de nanofeuillets SbpA, nous avons pu déterminer comment la variation des concentrations d'ions calcium et de SbpA affecte la taille et la forme de l'armure de la couche S."
Les détails de cette étude ont été publiés dans la revue ACS Nano dans un article intitulé "Contrôle spécifique aux ions de la dynamique d'auto-assemblage d'un réseau de protéines nanostructurées". Ajo-Franklin est l'auteur correspondant. Les co-auteurs sont Behzad Rad, Thomas Haxton, Albert Shon, Seong-Ho Shin et Stephen Whitelam.
Dans le monde microbien des bactéries et des archées, les menaces extérieures abondent. Leur environnement peut passer d'une chaleur extrême à un froid extrême, ou de très acide à très basique. Les prédateurs sont partout. Pour se protéger, de nombreuses bactéries et archées s'enferment dans une enveloppe de protéines de la couche S. Alors que les scientifiques connaissent ce revêtement protecteur depuis de nombreuses années, comment il se forme a été un mystère.
Ajo-Franklin et ses collègues ont exploré les protéines d'auto-assemblage comme moyen potentiel de créer des nanostructures avec une structure et une fonction complexes.
« A la Fonderie Moléculaire, nous sommes devenus très bons pour fabriquer des nanomatériaux sous différentes formes, mais nous apprenons toujours à assembler ces matériaux en structures organisées, " dit-elle. " Les protéines de la couche S sont des protéines biologiques abondantes connues pour s'auto-assembler en nanofeuillets cristallins 2D avec des symétries de réseau et des tailles de pores qui sont à peu près les mêmes dimensions que les points quantiques et les nanotubes. Cela en fait un système modèle convaincant pour la création de réseaux nanostructurés de matériaux organiques et inorganiques de manière ascendante. »
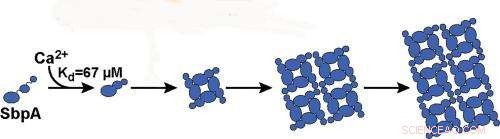
La liaison des ions calcium aux protéines SbpA démarre le processus par lequel le SbpA s'auto-assemble en nanofeuillets. Ca2+ se lie à SbpA avec une affinité de 67 M. Crédit :Image reproduite avec l'aimable autorisation du groupe Ajo-Franklin, Laboratoire de Berkeley
Dans cette dernière étude, des mesures de diffusion de la lumière ont été utilisées pour tracer des diagrammes qui ont révélé le rendement relatif des nanofeuillets auto-assemblés sur une large gamme de concentrations d'ions SbpA et calcium. En outre, les effets de la substitution des ions manganèse ou baryum aux ions calcium ont été examinés pour faire la distinction entre un rôle de cation divalent chimiquement spécifique et générique pour les ions calcium. Behzad Rad, l'auteur principal de la ACS Nano papier, et des collègues ont suivi la diffusion de la lumière par la lumière dans le spectre visible. Ils ont ensuite corrélé le signal à la formation de nanofeuillets en utilisant la microscopie électronique et la diffusion des rayons X aux petits angles (SAXS), une technologie qui peut fournir des informations sur les assemblages moléculaires dans à peu près n'importe quel type de solution. Les mesures SAXS ont été obtenues sur la ligne de lumière "SIBYLS (12.3.1) de la source lumineuse avancée de Berkeley Lab.
"Nous avons appris que seuls les ions calcium déclenchent le processus d'auto-assemblage SbpA et que les concentrations d'ions calcium à l'intérieur de la cellule sont trop faibles pour que des nanofeuillets se forment, ce qui est une bonne chose pour la bactérie, " dit Rad. " Nous avons également constaté que l'évolution temporelle des traces de diffusion de la lumière est cohérente avec la croissance irréversible de feuilles à partir d'un noyau négligeable. Dès que cinq ions calcium se lient à une protéine SbpA, le processus démarre et le cristal grandit très vite. Le petit noyau est ce qui fait fonctionner notre technique de diffusion de la lumière."
Ajo-Franklin, Rad et leurs co-auteurs pensent que leur technique de diffusion de la lumière est applicable à tout type de protéine qui s'auto-assemble en nanofeuillets 2D, et peut être utilisé pour surveiller la croissance de l'échelle nanométrique à l'échelle micrométrique.
Compte tenu de la nature robuste des protéines de la couche S et de leur qualité adhésive - les bactéries utilisent leur armure de couche S pour se fixer à leur environnement - de nombreuses applications intéressantes attendent une étude plus approfondie.
"Un projet que nous explorons utilise des protéines SbpA pour fabriquer des nanostructures adhésives qui pourraient être utilisées pour éliminer les métaux et autres contaminants de l'eau, " Ajo-Franklin dit. " Maintenant que nous avons une si bonne idée de la façon dont les protéines SbpA s'auto-assemblent, nous aimerions commencer à les mélanger et à les assortir avec d'autres molécules pour créer de nouvelles structures utiles. »