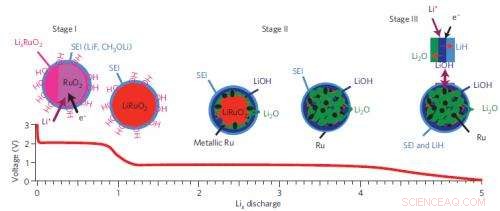
Un résumé de la voie de réaction en trois étapes du système de batterie ruthénium-oxyde-lithium.
Les batteries lithium (Li) ion alimentent presque tous les appareils électroniques portables que nous utilisons quotidiennement, y compris les téléphones intelligents, appareils photo, jouets, et même des voitures électriques. Des chercheurs du monde entier s'efforcent de trouver des matériaux qui conduiront à des pas cher, durable, et de puissantes batteries Li-ion.
Travaillant dans diverses installations de sources lumineuses du département de l'Énergie des États-Unis et dans les universités de Cambridge et de Stony Brook, un groupe de chercheurs a récemment étudié une classe d'électrodes de batterie Li-ion qui ont des capacités bien supérieures à celles des matériaux utilisés dans les batteries d'aujourd'hui. Les chercheurs voulaient déterminer pourquoi ces matériaux peuvent souvent stocker plus de charge que ne le prédit la théorie.
Les auteurs ont choisi l'oxyde de ruthénium (RuO2) comme système modèle pour étudier ces « matériaux de conversion, " nommés parce qu'ils subissent d'importants changements structurels lorsqu'ils réagissent avec les ions lithium, formant de manière réversible des nanoparticules métalliques et des sels (ici Ru et Li2O). Ces réactions sont très différentes de celles qui se produisent dans les électrodes conventionnelles, qui stockent la charge en permettant aux ions Li de se nicher dans les espaces du réseau cristallin.
"Notre enquête a identifié la source de la capacité supplémentaire trouvée pour RuO2, et a également produit un protocole pour étudier la « couche de passivation » qui se forme sur les électrodes de la batterie, qui protège l'électrolyte de subir d'autres réactions de décomposition dans les cycles de charge-décharge ultérieurs, " a déclaré le chercheur correspondant de l'étude, Claire Grey, professeur dans les départements de chimie des universités de Cambridge et de Stony Brook. « La compréhension des structures de ces couches de passivation est essentielle pour fabriquer des batteries qui durent suffisamment longtemps pour être utilisées dans des applications telles que le transport et le stockage sur le réseau électrique. »
À la source de lumière synchrotron nationale du Laboratoire national de Brookhaven, l'équipe a étudié leurs échantillons à l'aide d'une structure d'absorption proche des rayons X (XANES) et d'une structure fine d'absorption étendue de rayons X (EXAFS). À la source avancée de photons du Laboratoire national d'Argonne, ils ont utilisé deux techniques supplémentaires, analyse par diffraction des rayons X (XRD) et fonction de distribution de paires de diffusion (PDF) à haute résolution, pour extraire des informations sur les changements structurels électroniques et à longue/courte portée de l'électrode RuO2 en temps réel lorsque la batterie était déchargée et chargée. En utilisant ces méthodes, l'équipe a montré que RuO2 était réduit en nanoparticules de Ru et Li2O via la formation de phases intermédiaires, LixRuO2.
Comme cela n'expliquait pas la source du mécanisme de stockage de charge supplémentaire, le groupe a utilisé une autre technique, résonance magnétique nucléaire (RMN) à l'état solide à haute résolution. Cette méthode consiste à soumettre un échantillon à un champ magnétique et à mesurer la réponse des noyaux dans l'échantillon. Il peut fournir des informations spécifiques sur les compositions chimiques et les structures locales, et est particulièrement utile pour étudier des composés qui ne contiennent que des éléments "légers", comme l'hydrogène (H), Li, et de l'oxygène (O), qui sont difficiles à détecter à l'aide de XRD. Les données RMN ont montré que le principal contributeur à la capacité est la formation de LiOH, qui se transforme de manière réversible en Li2O et LiH. Les contributeurs mineurs à la capacité proviennent du stockage de Li sur les surfaces des nanoparticules de Ru, former un alliage LixRu, et la décomposition de l'électrolyte. Le dernier, cependant, provoque finalement une diminution de la capacité et entraînera la mort de la batterie après plusieurs cycles de charge.