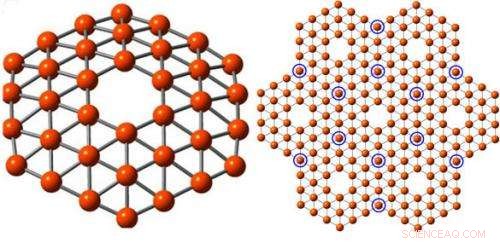
Cela montre un amas de 36 atomes de bore, la gauche, disposé comme un disque plat avec un trou hexagonal au milieu, répond aux exigences théoriques pour la fabrication d'une feuille de bore d'une épaisseur d'un atome, droit, un nanomatériau théorique baptisé « borophène ». Crédit :Wang Lab / Université Brown
Des chercheurs de l'Université Brown ont montré expérimentalement qu'un concurrent du graphène à base de bore est une possibilité très réelle.
Le graphène a été présenté comme un matériau miracle. Composé d'une seule couche d'atomes de carbone en nid d'abeille, le graphène est plus fort livre pour livre que l'acier et conduit mieux l'électricité que le cuivre. Depuis la découverte du graphène, les scientifiques se sont demandé si le bore, voisin du carbone sur le tableau périodique, pourraient également être disposés en feuilles à un seul atome. Les travaux théoriques ont suggéré qu'il était possible, mais les atomes devraient être dans un arrangement très particulier.
Le bore a un électron de moins que le carbone et, par conséquent, ne peut pas former le réseau en nid d'abeille qui constitue le graphène. Pour que le bore forme une couche à un seul atome, les théoriciens ont suggéré que les atomes doivent être disposés dans un réseau triangulaire avec des lacunes hexagonales - des trous - dans le réseau.
"C'était la prédiction, " dit Lai-Sheng Wang, professeur de chimie à Brown, "mais personne n'avait rien fait pour montrer que c'est le cas."
Wang et son groupe de recherche, qui a étudié la chimie du bore pendant de nombreuses années, ont maintenant produit la première preuve expérimentale qu'une telle structure est possible. Dans un article publié le 20 janvier dans Communication Nature , Wang et son équipe ont montré qu'un amas composé de 36 atomes de bore (B36) forme un disque d'un atome d'épaisseur avec un trou hexagonal parfait au milieu.
"C'est beau, " a déclaré Wang. " Il a une symétrie hexagonale exacte avec le trou hexagonal que nous recherchions. Le trou a ici une réelle importance. Cela suggère que ce calcul théorique sur une structure plane en bore pourrait être correct. »
C'est peut-être possible, Wang a dit, utiliser la base B36 pour former une feuille de bore plane étendue. En d'autres termes, Le B36 pourrait bien être l'embryon d'un nouveau nanomatériau que Wang et son équipe ont baptisé « borophène ».
"Nous n'avons encore qu'une seule unité, " a dit Wang. " Nous n'avons pas encore fait de borophène, mais ce travail suggère que cette structure est plus qu'un simple calcul."
Le travail a nécessité une combinaison d'expériences en laboratoire et de modélisation informatique. Dans le laboratoire, Wang et son élève, Wei-Li Li, Sonder les propriétés des amas de bore en utilisant une technique appelée spectroscopie photoélectronique. Ils commencent par zapper des morceaux de bore en vrac avec un laser pour créer de la vapeur d'atomes de bore. Un jet d'hélium gèle ensuite la vapeur en de minuscules amas d'atomes. Ces clusters sont ensuite zappés avec un deuxième laser, qui fait sortir un électron de l'amas et l'envoie voler dans un long tube que Wang appelle son "piste d'électrons". La vitesse à laquelle l'électron vole sur l'hippodrome est utilisée pour déterminer le spectre d'énergie de liaison des électrons de l'amas, une indication de la force avec laquelle l'amas retient ses électrons. Ce spectre sert d'empreinte digitale de la structure du cluster.
Les expériences de Wang ont montré que le cluster B36 était quelque chose de spécial. Il avait une énergie de liaison aux électrons extrêmement faible par rapport aux autres amas de bore. La forme du spectre de liaison de l'amas suggérait également qu'il s'agissait d'une structure symétrique.
Pour savoir exactement à quoi pourrait ressembler cette structure, Wang se tourna vers Zachary Piazza, l'un de ses étudiants diplômés se spécialisant en chimie computationnelle. Piazza a commencé à modéliser des structures potentielles pour B36 sur un superordinateur, enquête sur plus de 3, 000 arrangements possibles de ces 36 atomes. Parmi les arrangements qui seraient stables figurait le disque plan avec le trou hexagonal.
"Dès que j'ai vu ce trou hexagonal, " Wang a dit, "J'ai dit à Zach, « Nous devons enquêter là-dessus. »
Pour s'assurer qu'ils ont vraiment trouvé l'arrangement le plus stable des 36 atomes de bore, ils ont demandé l'aide de Jun Li, qui est professeur de chimie à l'Université Tsinghua de Pékin et ancien chercheur principal au Pacific Northwest National Laboratory (PNNL) à Richland, Laver. Li, un collaborateur de longue date de Wang, a développé une nouvelle méthode pour trouver des structures stables de clusters, qui conviendrait au travail à accomplir. Piazza a passé l'été 2013 au PNNL à travailler avec Li et ses étudiants sur le projet B36. Ils ont utilisé le superordinateur du PNNL pour examiner davantage d'arrangements possibles des 36 atomes de bore et calculer leurs spectres de liaison aux électrons. Ils ont constaté que le disque plan avec un trou hexagonal correspondait très étroitement au spectre mesuré dans les expériences de laboratoire, indiquant que la structure Piazza trouvée initialement sur l'ordinateur était bien la structure de B36.
Cette structure répond également aux exigences théoriques de fabrication du borophène, ce qui est une perspective extrêmement intéressante, a dit Wang. La liaison bore-bore est très forte, presque aussi fort que la liaison carbone-carbone. Le borophène devrait donc être très fort. Ses propriétés électriques peuvent être encore plus intéressantes. Le borophène devrait être entièrement métallique, alors que le graphène est un semi-métal. Cela signifie que le borophène pourrait finir par être un meilleur conducteur que le graphène.
"C'est-à-dire, " Wang met en garde, "si quelqu'un peut le faire."
A la lumière de ce travail, cette perspective semble beaucoup plus probable.