
Cette micrographie AFM de couches S 2-D assemblées sur du mica montre deux voies différentes vers la cristallisation, un dans lequel les domans sont 2-3 nanomètres plus grands (cercles pointillés blancs) que l'autre. Différences dans les deux profils de hauteur, qui ont été mesurés le long des lignes noires horizontales en pointillés, étaient le résultat d'un piégeage cinétique. Crédit :Fonderie Moléculaire
(Phys.org) - Les protéines sont capables de s'auto-assembler en un large éventail de structures hautement ordonnées qui présentent un large éventail de propriétés. Grâce au biomimétisme - innovation technologique inspirée de la nature - les humains espèrent émuler des protéines et produire leur propre version de molécules auto-assemblantes. Une clé pour y parvenir est de comprendre comment le repliement des protéines - un processus essentiel à la forme et à la fonction d'une protéine - s'étend des protéines individuelles aux assemblages complexes.
Des chercheurs du Lawrence Berkeley National Laboratory (Berkeley Lab) du département américain de l'Énergie (DOE) ont maintenant montré qu'un concept largement accepté comme décrivant le repliement d'une seule protéine individuelle est également applicable à l'auto-assemblage de plusieurs protéines. Leurs résultats fournissent des lignes directrices importantes pour les futurs efforts de biomimétisme, en particulier pour la fabrication de dispositifs et la synthèse à l'échelle nanométrique.
"Nous avons fait les premières observations directes selon lesquelles le concept d'entonnoir repliable avec des pièges à énergie cinétique pour des protéines individuelles peut également être appliqué à l'assemblage de structures protéiques ordonnées, " dit Jim DeYoreo, un scientifique de la Fonderie Moléculaire, un centre de nanosciences du DOE au Berkeley Lab, qui a dirigé cette recherche avec la chimiste du Berkeley Lab Carolyn Bertozzi. "Nos résultats nous indiquent que les efforts pour découvrir et codifier les règles de conception pour l'auto-assemblage de systèmes moléculaires complexes devront prendre en compte l'impact des pièges cinétiques associés aux transformations conformationnelles."
DeYoreo et Bertozzi sont les auteurs correspondants d'un article publié par le Actes de l'Académie nationale des sciences (PNAS) qui a rapporté cette recherche. L'article s'intitule "Observation directe des pièges cinétiques associés aux transformations structurelles conduisant à de multiples voies d'assemblage de la couche S". Les co-auteurs de l'article étaient Seong-Ho Shin, Sungwook Chung, Babak Sanii et Luis Comolli.
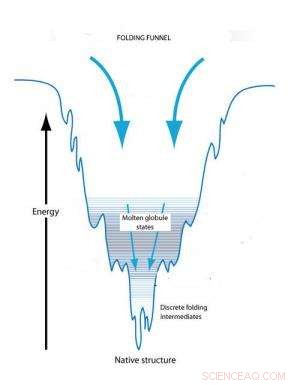
Le concept d'entonnoir de repliement explique le repliement des protéines sur la base de changements de conformation pour atteindre un état d'énergie libre minimale. Une protéine dépliée commence dans un état de haute liberté et atteint son état natif à une énergie minimale. Les pièges cinétiques en cours de route peuvent créer des globules fondus transitoires et des intermédiaires de repliement.
Les protéines sont essentiellement des nanomachines biomoléculaires capables d'effectuer de nombreuses tâches en raison de leur capacité à se replier en une multitude de formes et de formes. Lorsque des protéines individuelles s'auto-assemblent en structures ordonnées, l'ensemble résultant adopte souvent des conformations tout à fait distinctes de celles des composants individuels.
"Par exemple, matrices de collagène, qui constituent les échafaudages organiques des os et des dents, sont construits à partir de triples hélices de monomères de collagène individuels, " dit DeYoreo. "Ces hélices s'assembleront davantage en fibrilles torsadées hautement organisées qui présentent une symétrie pseudohexagonale."
Le concept d'entonnoir de repliement explique le repliement individuel des protéines sur la base de changements de conformation pour atteindre un état d'énergie libre minimale. Une protéine dépliée commence dans un état d'énergie libre élevée qui rend sa conformation instable. Initialement, il existe un certain nombre de conformations tridimensionnelles possibles qui réduiraient cette énergie libre. Cependant, lorsque la protéine commence à se replier, l'énergie libre commence à baisser et le nombre de conformations possibles commence à diminuer comme la largeur rétrécissante d'un entonnoir. Le fond de l'entonnoir est atteint lorsque l'énergie libre est minimisée et qu'il n'y a qu'une seule conformation disponible. Au fur et à mesure que l'énergie libre diminue, cependant, il peut y avoir des pièges cinétiques en cours de route qui peuvent arrêter le processus de repliement et maintenir la protéine dans des conformations partiellement repliées, appelés globules fondus et intermédiaires de repliement, pendant des périodes prolongées. Finalement, ces états conformationnels piégés seront transformés en une conformation stable, mais la forme et la forme de cette conformation finale sont influencées par les pièges cinétiques.
"Dans un entonnoir de repliement des protéines, les parois de l'entonnoir sont présumées ne pas être lisses et les bosses et creux résultants définissent des pièges cinétiques, " dit DeYoreo. " Cette image physique du repliement a été explorée en détail au niveau d'une seule molécule, mais n'a pas été envisagée pour l'auto-assemblage des protéines dans des architectures étendues, même si les transformations conformationnelles font partie intégrante du processus d'auto-assemblage. »
DeYoreo, Bertozzi et leurs collègues ont pris des mesures pour corriger ce déficit de connaissances en étudiant les protéines de la couche de surface (couche S) qui s'auto-assemblent en une membrane cristalline autour des cellules individuelles des bactéries et des archées. Cette membrane externe sert de premier point de contact entre le microbe et son environnement et est la clé de la capacité du microbe à survivre. En utilisant la Microscopie à Force Atomique (AFM) in situ, les chercheurs ont imagé en temps réel et au niveau moléculaire le piégeage cinétique lors de l'auto-assemblage 2D des structures protéiques de la couche S sur des surfaces de mica.
"Nous avons observé que l'auto-assemblage des protéines de la couche S suit deux voies différentes, celui menant directement à la finale basse énergie, état ordonné, et l'autre conduisant à un piège cinétique occupé par un état transitoire de longue durée plus désordonné, " dit DeYoreo. " Bien que l'un ou l'autre état soit facilement accessible pendant la nucléation du cristal, si le système tombe dans l'état de haute énergie, échapper à la finale, l'état de basse énergie est fortement entravé à température ambiante. Cela démontre l'importance des pièges cinétiques dans la détermination de la voie de cristallisation de la couche S et suggère que le concept d'entonnoirs de repliement est également valable pour l'auto-assemblage de structures protéiques étendues."